第六章
|
|
|
|
消化道壁的超声影像解读
在EUS应用早期,研究者主要将注意力放在更好地显示内脏器官,尤其是体表超声检查显示不理想的部位,如心脏、胆总管下段、胰腺、左肾上腺等等。继而,研究者开始将EUS应用在检查消化道壁疾病。目前,显示消化道壁的层次结构被证明是EUS的主要优势之一。
一般的EUS(探头频率7.5MHz)将消化道壁显示为回声不同的五层结构(图6-1)。在影像上,五层结构平行于黏膜表面。第一层结构(也就是消化道壁最内层的结构)是高回声(亮,白),第二层是低回声(暗),第三层是高回声,第四层是低回声,第五层(也就是消化道壁最外一层)是高回声。
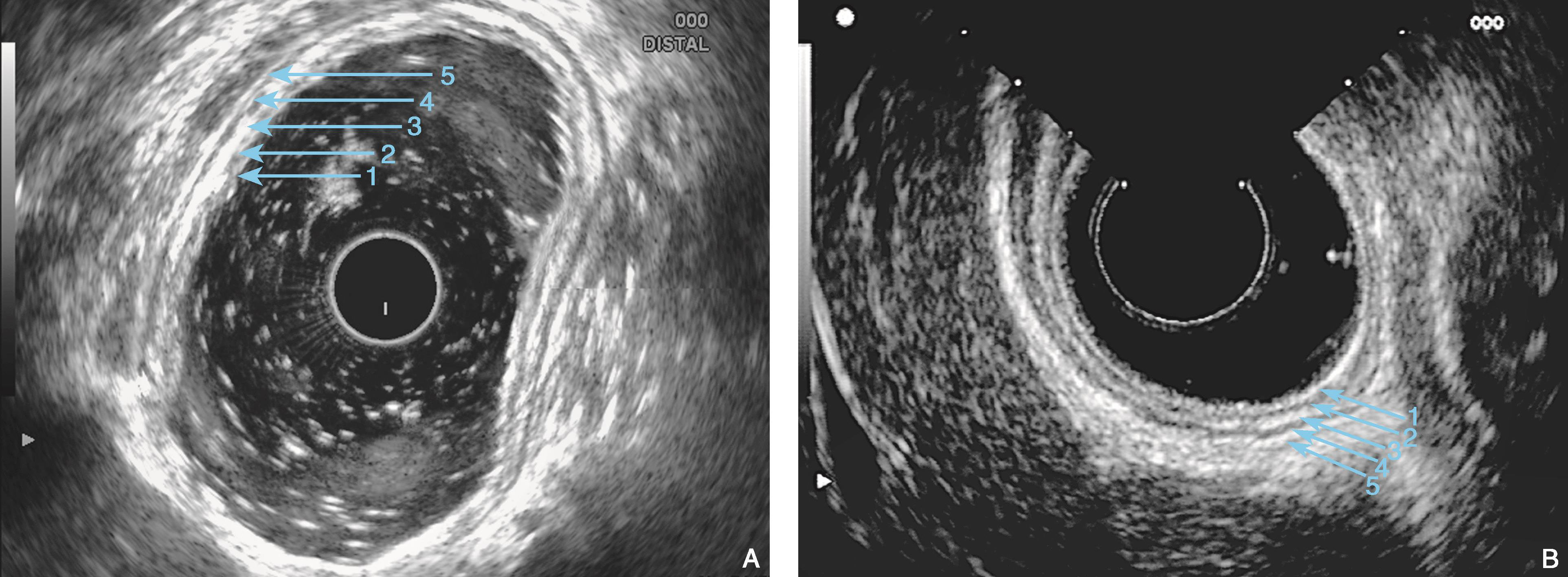
图6-1 消化道壁在EUS下显示为五层结构
(A)水充盈法:可清晰显示胃体胃壁各层结构。正常胃皱襞(三角箭头指示)处为胃黏膜下层发达向腔内形成突起(环扫,10MHz);(B)水囊法:胃壁的厚度受水囊压迫的影响(环扫,10MHz)
早期的理论曾认为,消化道壁的组织结构也可以区分为五层:黏膜层、黏膜肌层、黏膜下层、固有肌层和浆膜,可一一对应于EUS的五层结构。然而,EUS显示消化道壁各层结构的厚度几乎是相同的,这就与超声五层结构对应于组织学五层结构的假说产生了矛盾,因为消化道壁实际的各层解剖结构的厚度是不相同的 [1] 。黏膜肌层可能仅仅几微米,我们肉眼都无法观察消化道壁的黏膜肌层,因而其绝对不可能在超声下显示为与其他各层厚度相近的一层结构。第三层结构在空间上与黏膜下层对应,然而声像图上测量的第三层的厚度比黏膜下层实际测量的厚度大很多。此外,超声五层结构的总厚度也比消化道壁的全层厚。很明显,超声五层结构与消化道壁的实际解剖结构并无精确一对一的关系。原先的假说忽略了超声影像形成机制,即超声的五层结构不仅是由组织结构的内部回声组成,也同时由组织间界面回声组成。
我们前面已提到界面的概念,它是具有两种不同声阻抗的组织接触在一起时形成的,当换能器发出的超声声束接触到界面时,会产生反射波(回声)。回声的强度取决于界面的反射系数,也就是两组织间声阻抗的差异,而声像图上显示界面的回声厚度取决于设备的轴向分辨率。在一般生物组织介质中,声波反射系数很低,而传导系数很高,因而一束声波会连续产生多个界面的多重回声。在某些特殊的情况下,反射系数特别高,使界面后的影像不能显示,如骨、结石和气体。
组织中的回声来自于散射现象。当一束声波在组织中发生散射时,小部分的声波能量再次被反射,不是以特定的方向,而是全方位的,最终仅有一小部分声波被探头接收,因而形成均匀的组织超声影像,回声强度一般较低。组织的散射能力,取决于引起散射物质的浓度和超声频率。提高超声的频率会使散射强度明显增加。生物组织中能引起回声的物质有:大分子(如胶原、纤维素、弹性蛋白和脂质)、细胞、矿物质(如骨、结石)和气体。
从解剖上看,消化道壁的断面为同心圆样的多层结构。研究超声对应组织结构的模型基于两种假设:首先,连接两种组织层之间的界面是声学界面,产生高回声。其次,每层组织内部的回声是均匀的。因而消化道壁的超声影像是由各层组织内部回声被界面的高回声隔开形成的。
超声影像上的“深度”和“厚度”实际上测量的并不是真正的距离,而是测量的声束传播时间。超声影像上的厚度代表超声从换能器发出、传播至目标界面、并反射回换能器所需的时间。当声速恒定时,时间与距离成正比。前面章节中已提到,在软组织中,声速是相对稳定的。因而测量超声传播的时间就能推算出长度和距离。但实际上组成消化道壁的各层组织的声阻抗不同,超声在不同组织中的声速也并不完全相同,因而不同组织中相同的超声传播时间代表的厚度并不相同,只是目前的技术还难于实时测量不同组织中的声速,所以只能近似测量目标厚度。
两组体外研究报道了消化道壁超声影像最合理的解读方案 [2,3] 。Kimmey等人考虑了组织结构、组织声像特点和超声的物理特性,基于对切除组织的研究提出了消化道壁的声像解读理论。他们认为超声影像的总体表现由两种来源的回声组成:不同声阻抗组织层的界面回声和组织层内部结构的回声。如果浅层是高回声而深层是低回声,那么界面回声增加了浅层组织的厚度,而深层组织的厚度减少。如果浅层是低回声而深层是高回声,那么界面回声无法从深层组织的回声中区分出来,因而对浅层组织和深层组织的声像厚度均无影响。
通过超声对食管、胃、十二指肠等切除组织的观察得出对应关系如下(图6-2):第一层高回声对应于黏膜浅层,第二层低回声对应于黏膜深层,第三层的高回声代表黏膜下层和黏膜下层与固有肌层之间的界面回声,第四层的低回声对应于剩余的固有肌层,第五层对应于浆膜层和浆膜下脂肪(在食管,对应于固有肌层的外膜和周围组织的界面回声)。应用分辨率较高的探头,食管壁还可能显示为七层结构,第四层结构被一层高回声分为两层低回声,这需要探头与黏膜之间保持一定的距离。这层薄的高回声由固有肌层的内环肌和外纵肌之间的界面产生。
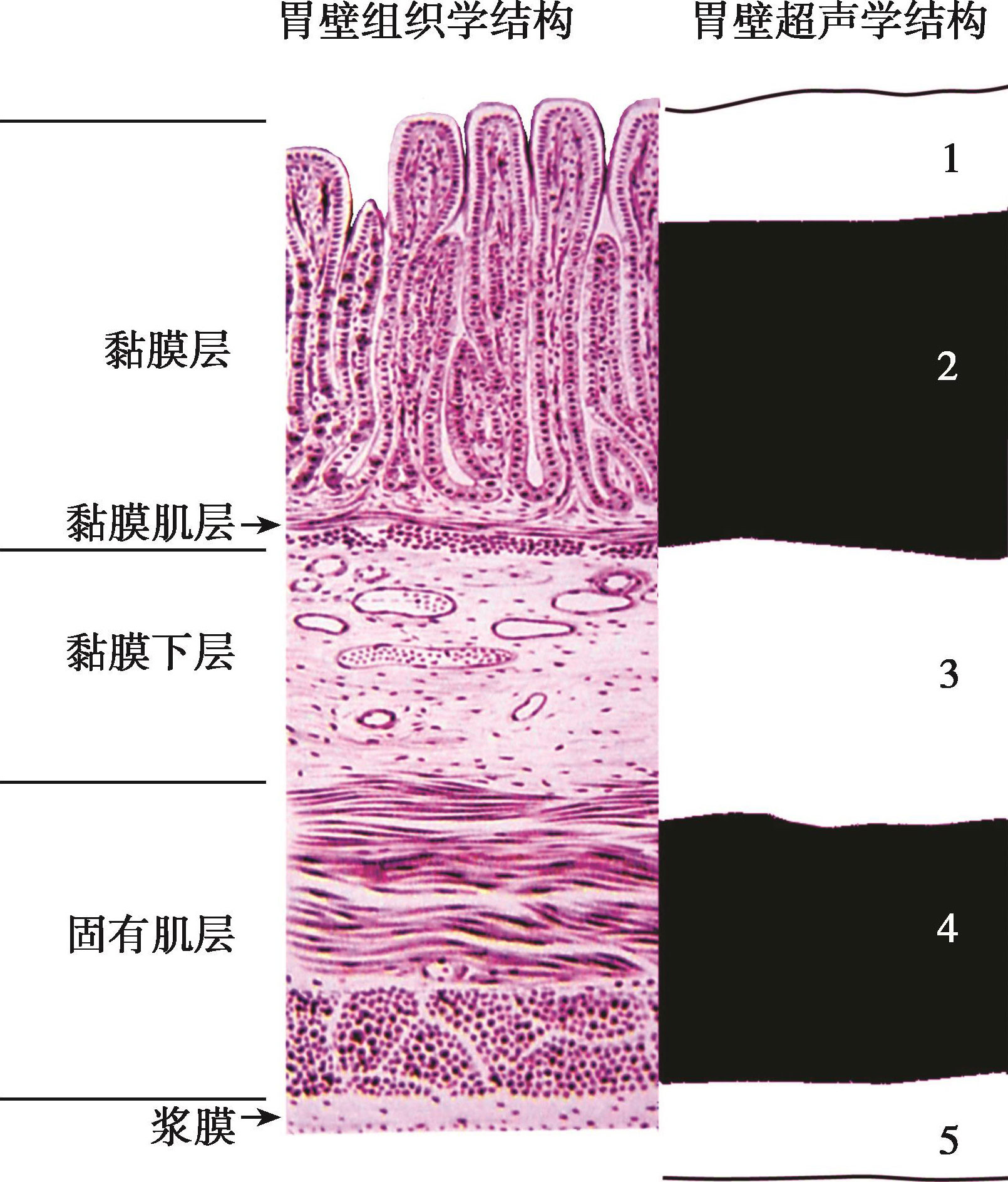
图6-2 消化道壁的五层结构与EUS显示的

显示消化道壁可以采用直接接触法、水充盈法和水囊法,最好的方法是水充盈法,这样探头和消化道壁之间可以保持一定的距离,使目标接近于超声探头的焦距,而且探头与黏膜之间无过大的压力,所以得到的影像比较清晰。但消化道某些部位的管腔内很难潴留液体,如食管、十二指肠等。对这些部位可采用水囊法或持续注水法,持续注水法患者比较痛苦。而应用水囊法时,水囊通常对管腔有一定压力,也将影响影像的质量。
Odegaard等 [4] 人证实了当探头与消化道壁接触时,压力对消化道壁的超声影像有显著影响。当超声换能器对消化道壁组织的压力增加时,消化道壁的厚度、组织回声强度和各层结构的显示都有明显变化。随着压力的提高,消化道壁的回声强度会增加,但某些组织层会消失,消化道壁的第二层超声结构(相当于黏膜深层)对压力最敏感。食管、十二指肠和结肠比胃和直肠更敏感。在低于10kPa的压力下食管壁显示为五层结构,当压力大于10kPa时,第二层结构消失,第一层与第三层结构融合,于是食管壁显示三层结构。Odegaard等人得出结论:限制EUS探头对食管壁的压力可以减少食管EUS的伪像。
因而,组织学中各层结构与EUS下的各层结构并不完全对应,我们习惯将两种层次结构分别称为“组织学结构”和“内镜超声结构”。
一、人体内消化道壁结构的EUS检查
(一)食管
EUS测正常食管壁的厚度约3~3.5mm。
如将探头离开食管壁,探头和食管壁之间很难充满水,注水机持续注水虽可使食管得到动态充盈,但应当注意避免误吸;如果将探头直接接触在食管壁上,那么探头不能聚焦在食管壁上获得清晰的影像;如将探头上的水囊充水,水囊对食管壁的压力也将影响食管壁结构的显示,而且通常又很难控制水囊对食管壁的合适压力,所以虽然正常的食管壁一般显示为五层结构,但在水囊法时食管壁成像也常显示为三层结构(图6-3)。在显示三层结构的情况下,第一层高回声,对应于水囊壁、黏膜、黏膜下层,以及黏膜下层与固有肌层的界面回声。第二层低回声对应于固有肌层。第三层高回声代表固有肌层和食管周围组织之间的界面回声。而应用高分辨率的超声内镜,可以显示食管固有肌层内环肌层和外纵肌层的界面回声,从而使管壁显示为七层结构(图6-4)。
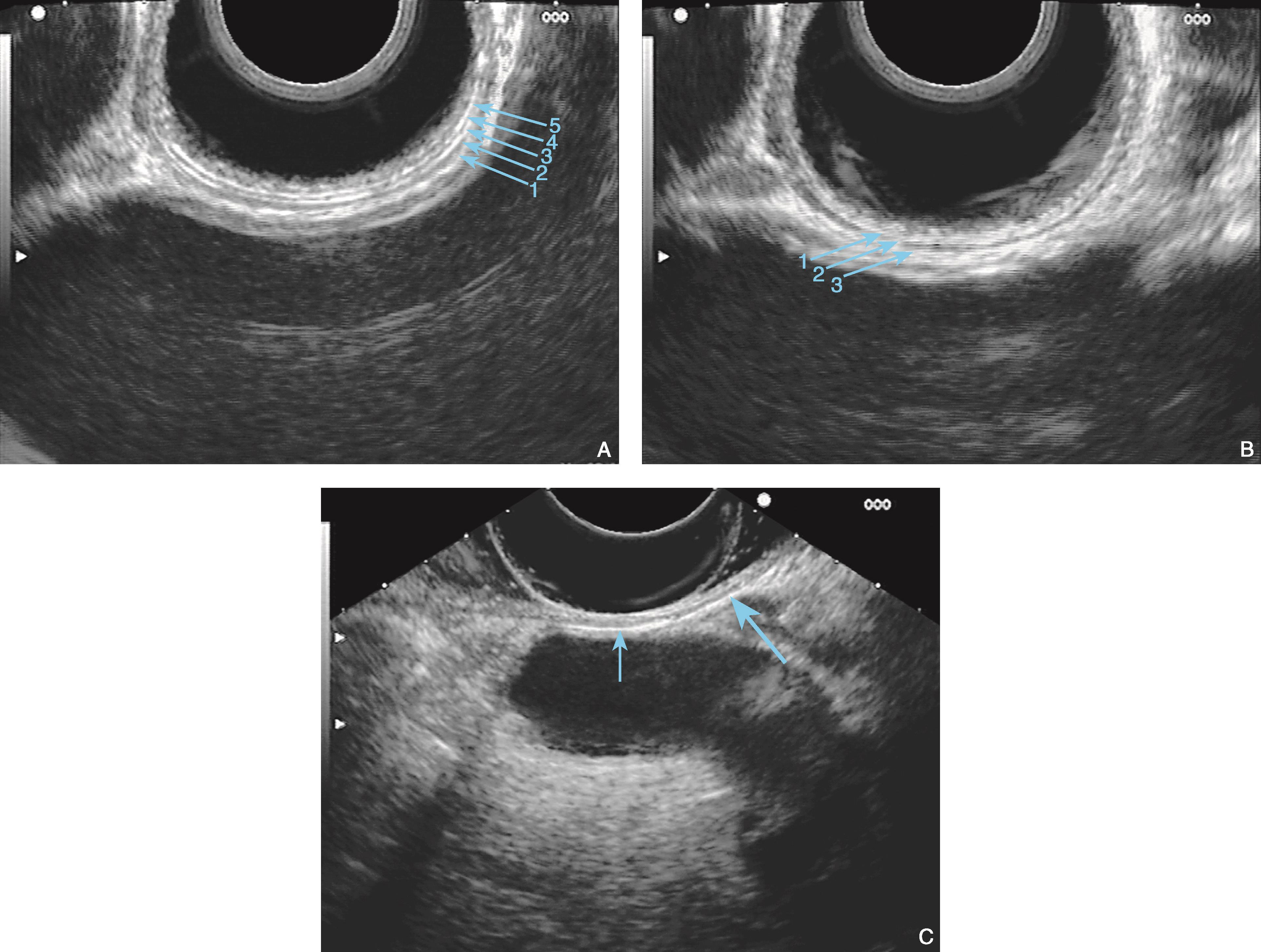
图6-3 食管壁的内镜超声结构
(A)探头位于食管中段,合适的条件下可以显示为五层结构(环扫,10MHz);(B)增加水囊对食管壁的压力,1~3层超声结构融合,食管壁显示为三层结构(环扫,10MHz);(C)水囊压迫下(细箭头)呈三层超声结构,边缘处(粗箭头)呈五层超声结构(线阵,7.5MHz)
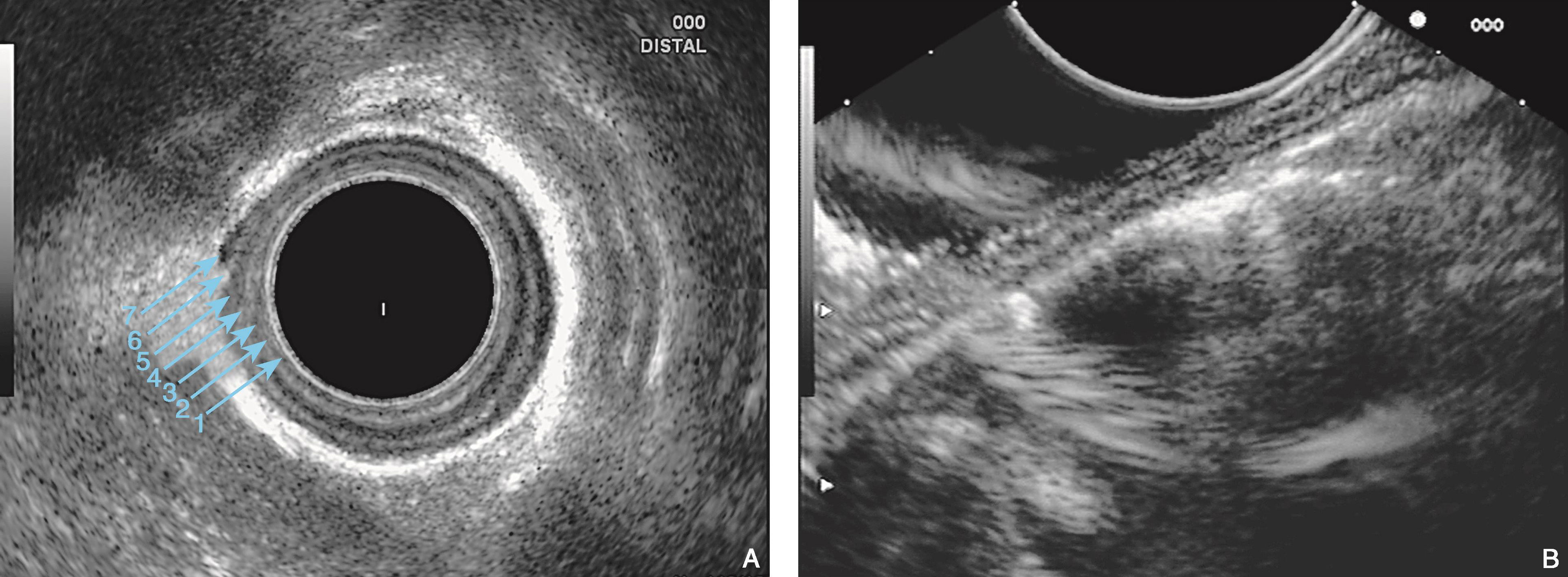
图6-4 食管壁的内镜超声结构
(A)电子环扫探头置于食管下段,在10MHz下超声第四层结构可显示为三层结构(中间的强回声为环行肌与纵行肌之间的界面回声),食管壁全层呈七层超声结构;(B)线阵探头由于声束部分垂直入射界面,所以只能局部显示为七层结构
为了鉴别食管壁的病变,应在进行EUS检查前首先在内镜视野下找到要检查的病变,然后调整探头的位置,使之对准病变。对于食管中上段的病变可采取水囊法,将水囊充水,将大螺旋向上调,使探头离开病变而保持水囊接触病变,根据病变受压变形的情况来调整水囊的压力,可在食管腔内少量注水,然后将食管腔内的气体吸出,通过轻微旋转镜身或进退镜来观察病变。
对于食管下段病变,也可以采取这种方法。但如果为了更好地显示食管的五层结构,可以将患者的头略抬高,对胃内和食管下段大量注水,然后排出胃底和食管下段的气体,使水充盈食管下段,这样可以清晰显示食管壁和贲门的五层结构。
(二) 胃
EUS测正常胃壁的厚度约3~4.5mm。
充水的胃很容易显示典型的五层结构(图6-5~图6-7)。胃窦部胃壁与胃底部、胃体部相比略厚。胃窦远端和幽门部的第四层结构更明显。尽管如此,初学者要清晰显示胃窦的五层结构有时也不容易,尤其是检查胃窦远端(幽门前区)的病变。因为患者左侧卧位时,胃窦在上方,即使胃腔内有很多液体,胃窦也很难充盈,EUS显示效果很差,所以针对胃窦充水困难,有学者提出让患者向右侧翻身来检查胃窦特殊病变,但采用这种方法患者较为痛苦而且危险。所以在给胃腔充水的同时将胃腔内气体排空后,水一般可以充盈胃窦。此外,注水应注意适量,尤其是重点显示胃外病变时更要注意,过多的水将影响超声显示距胃较远的脏器和彩色多普勒功能的应用。
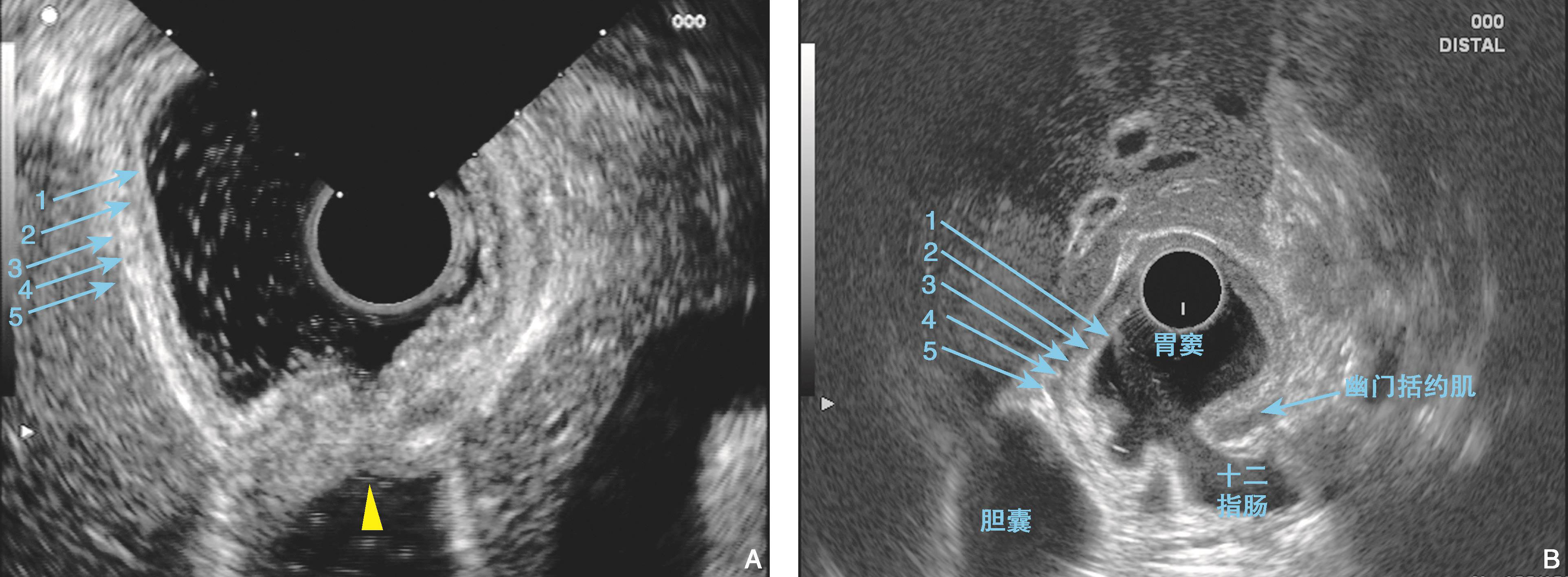
图6-5 胃窦的内镜超声结构
(A)(B)超声探头位于胃窦部显示胃壁五层结构(环扫,10MHz),切面沿胃窦轴向,可显示幽门断面(三角箭头指示),幽门远侧为十二指肠球部(三角箭头所在位置)
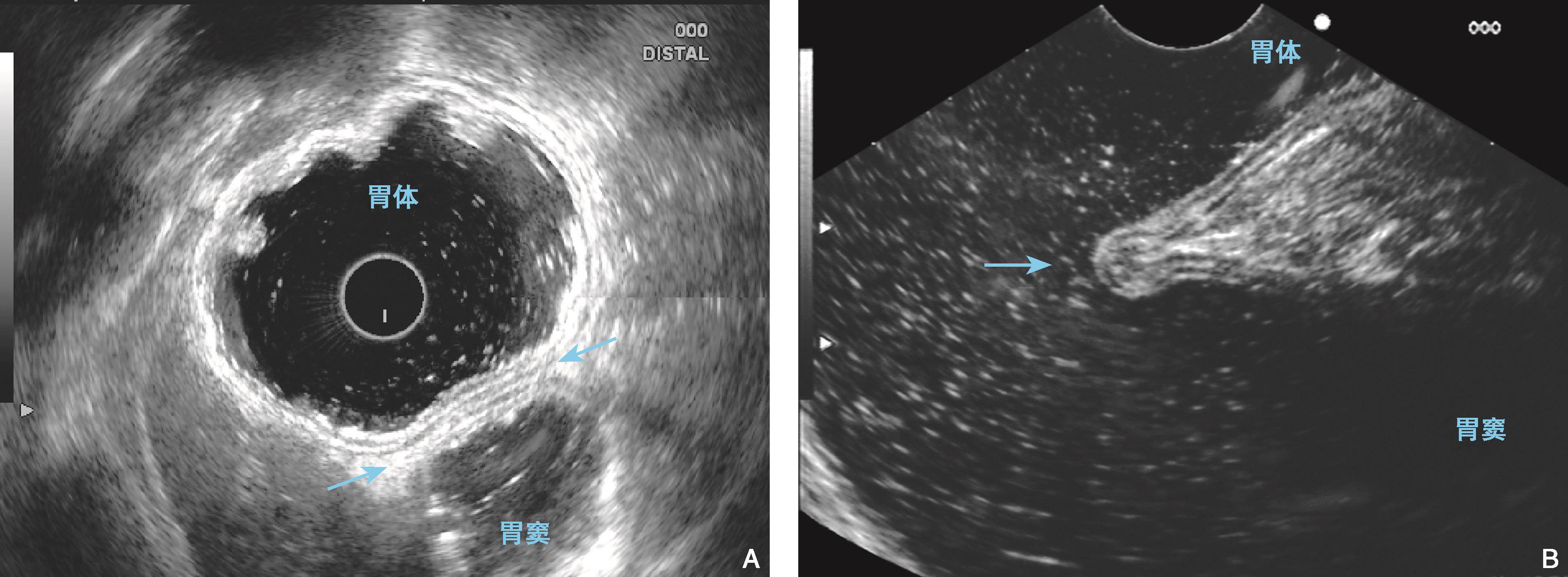
图6-6 胃角的内镜超声结构
(A)电子环扫探头(10MHz)置于胃体下部,可扫描胃角横切面(两箭头之间),胃角两侧为胃体及胃窦;(B)电子线阵探头(7.5MHz)置于胃体下部,可扫查胃角纵切面(箭头指示),胃角处显示胃壁超声五层结构折叠。胃角两侧分别为胃体及胃窦。当直接观察胃窦小弯侧有困难时,可于胃体部观察胃窦的超声五层结构
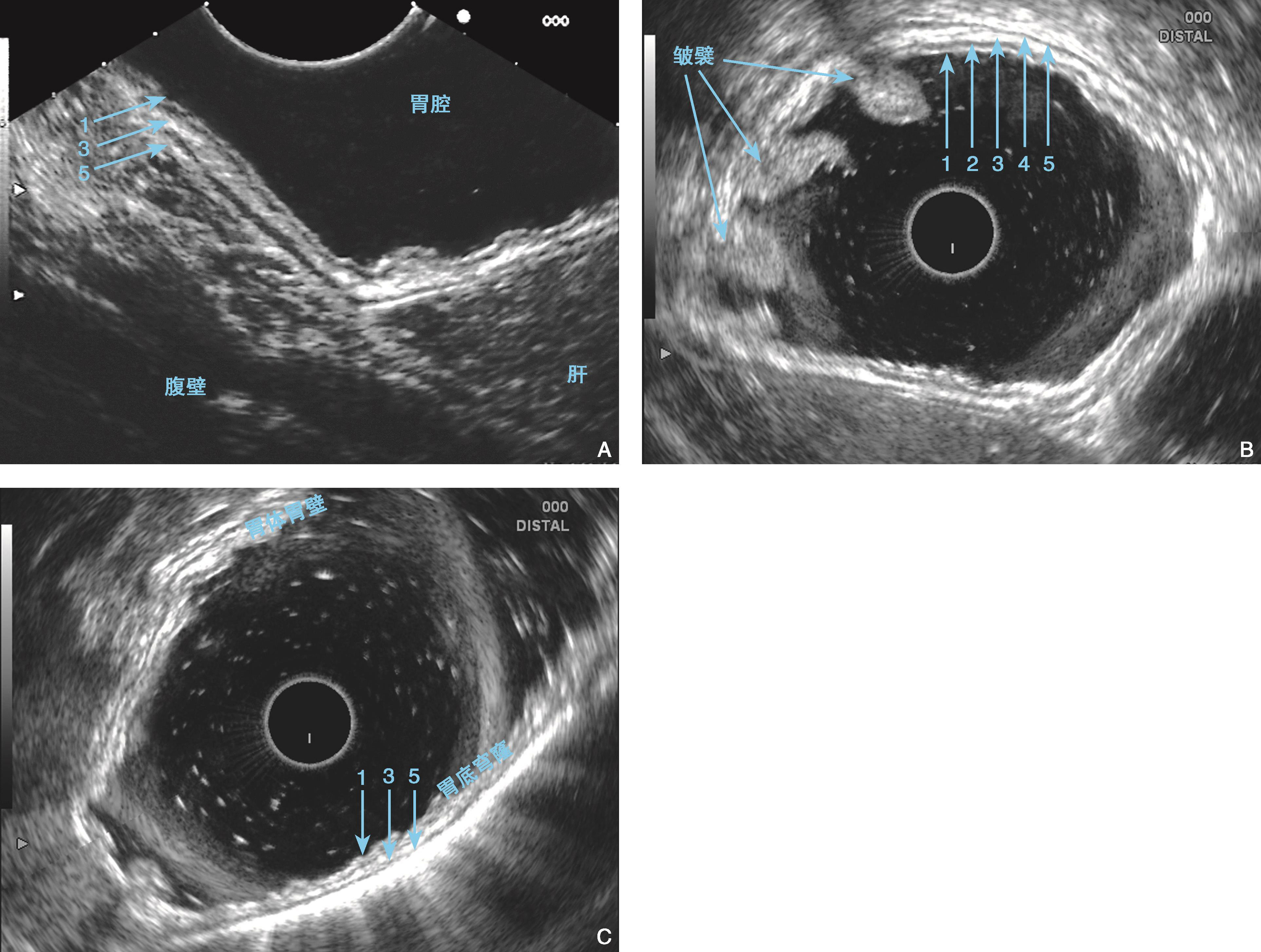
图6-7 胃底体的内镜超声结构
(A)电子线阵探头(10MHz)位于胃体前壁显示胃壁五层结构,并可显示胃壁外的肝脏和腹壁;(B)电子环扫探头(10MHz)置于胃体显示胃壁五层结构;(C)电子环扫探头(10MHz)置于胃底穹窿部,可显示胃底胃壁及胃体胃壁
对胃窦小弯侧的部分,用线阵超声内镜扫查相对容易,将胃窦腔充满水后,使探头朝向病变,并保持一定的距离就可清晰显示病变。如果要用线阵超声内镜显示胃大弯的病变,需向右旋转内镜,将大螺旋向上调,使内镜镜身顺应胃腔的走行,同时探头朝向大弯侧。
胃体、胃底部的超声观察比较容易,只需少量(<300ml)注水并排出胃底部的气体就可清晰显示胃壁的结构。针对胃体部的检查,环扫的超声内镜无需特殊的操作。线阵式超声内镜通过旋转镜身,将探头朝向我们感兴趣的部位,旋转360°将胃体腔检查完全。针对胃底部的检查,与常规内镜检查做“U反转”的操作方法类似,只是常规内镜可以在胃窦向上反转,超声内镜由于硬性部长,需将内镜退至胃底体交界处,向下调大螺旋,向右转镜,内镜视野下可以见到胃底或贲门的同时,探头也朝向了胃底。有时为了调整声束入射的方向,使声束更垂直于胃底的界面,可以在超声内镜呈“U反转”的情况下,稍进镜,更易于显示接近贲门的胃底部胃壁病变。
(三)十二指肠
EUS测正常十二指肠壁的厚度约2~3mm。
十二指肠的情况类似于食管,也可显示为五层结构,但由于十二指肠壁球部黏膜深层有丰富的布氏腺组织与黏膜下层回声相近,使超声第一层与第三层结构趋于融合,所以十二指肠球部肠壁的超声结构较为模糊(图6-8)。十二指肠降部的超声五层结构较球部更容易观察(图6-9)。
为了较好地显示十二指肠的病变,应当快速大量注水。由于十二指肠腔较小,快速注水,使十二指肠腔内的水保持动态平衡。所以显示十二指肠壁的病变,应当在肠腔内注水。
线阵探头需改变朝向时,应当借助拉直内镜的手法。对十二指肠球右侧壁,探头显示不困难,对十二指肠左侧壁,需轻拉内镜并向右旋,使探头朝向病变。
(四)直肠或结肠
EUS测正常直肠壁的厚度约3~4mm,结肠约2~3mm。
要显示大肠的超声五层结构通常要采取水充盈法(图6-10)。个别情况下也可采取水囊法,但结肠的超声五层结构的清晰度对水囊的压迫敏感,而水囊的压迫对直肠的影响相对较小。
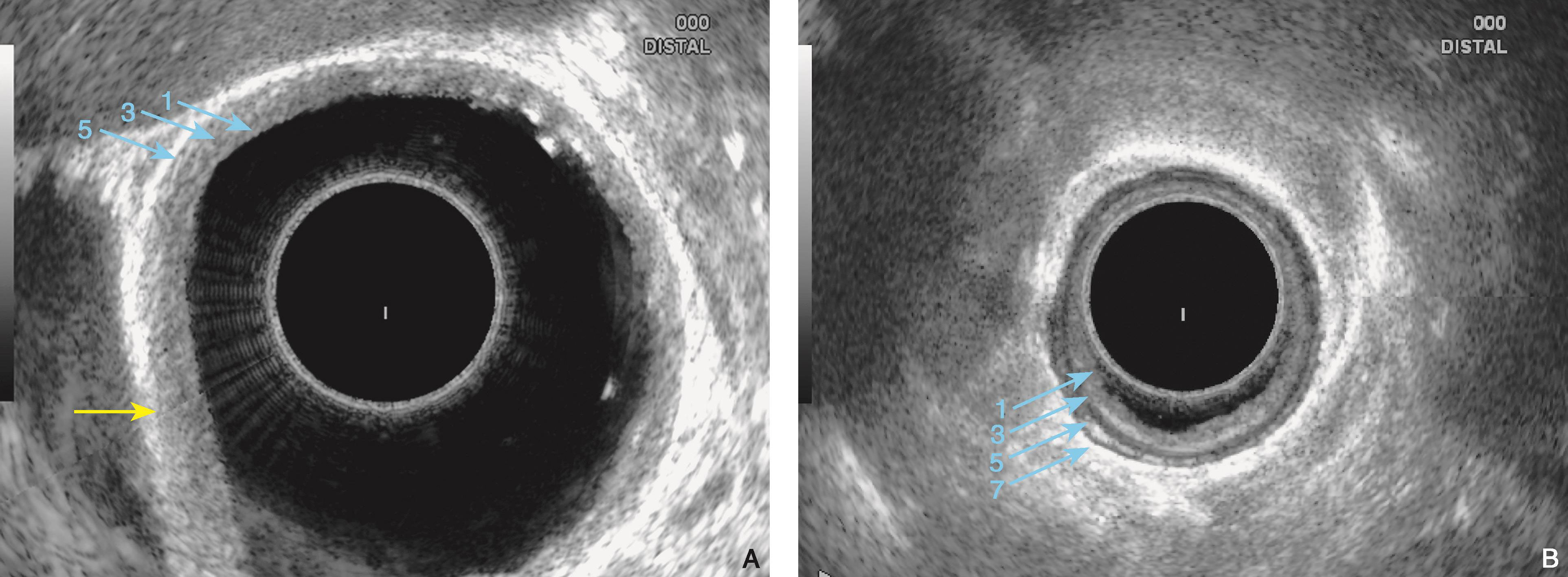
图6-8 十二指肠壁的内镜超声结构
(A)十二指肠球部组织结构特点决定了其超声五层结构较胃和食管模糊;(B)然而,有时十二指肠球腔也可显示为七层结构(环扫,10MHz)
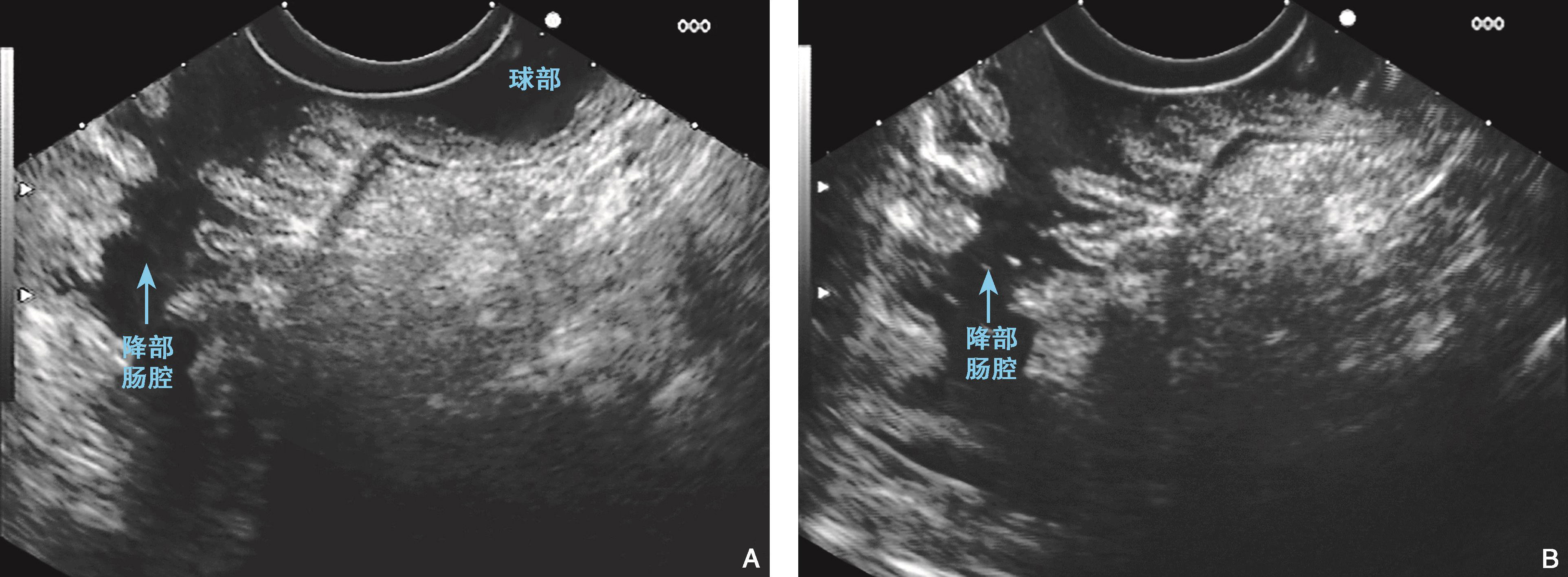
图6-9 十二指肠壁的内镜超声结构
(A)(B)十二指肠降部肠壁的超声层次结构较球部更清晰(线阵,7.5MHz)。降部的皱襞较多,皱襞处显示超声第三层结构发达
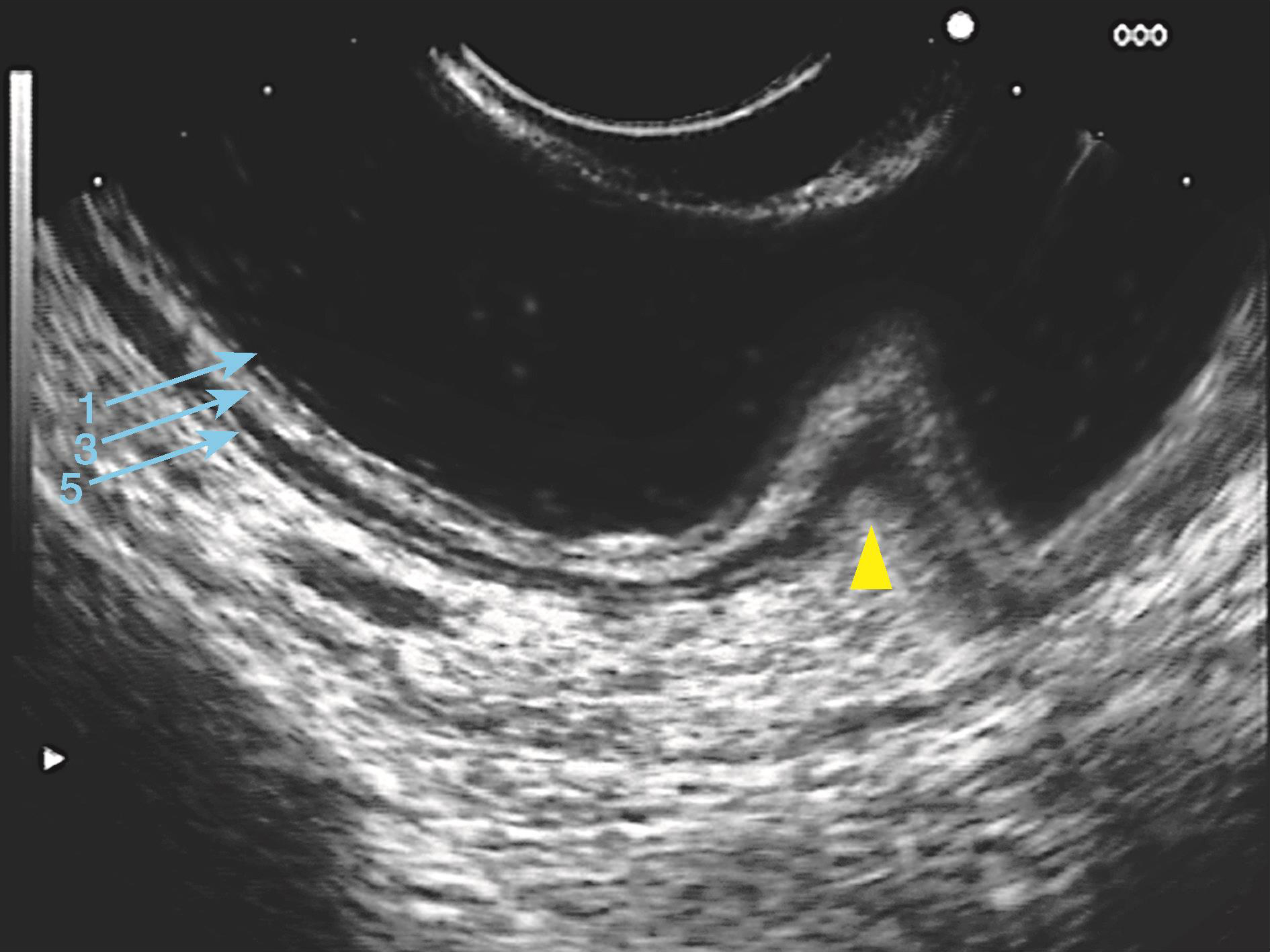
图6-10 直肠的内镜超声结构
水充盈法显示直肠肠壁的超声五层结构(线阵,7.5MHz),直肠皱襞为肠壁向腔内折叠(三角箭头处)
二、消化道壁的病变
通过对消化道壁的五层结构变化的观察,我们检查消化道壁各层的病变。
(一)显示消化道壁结构
从临床研究结果来看 [1] ,胃壁疾病EUS诊断的特异性为97%,阴性预测值为87%,敏感性为94%,阳性预测值为99%。说明EUS诊断胃壁结构正常与异常的可信度很高。胃壁结构轻微的以及明显的改变一般都能为EUS所发现 [5] 。
(二)各种病变的鉴别
虽然并不是所有的病变都有特征性表现,但某些疾病如胃肠间质瘤、食管平滑肌瘤、胃淋巴瘤、浸润型胃癌,在EUS下往往有典型表现。EUS能显示病变位于消化道壁的一层或多层,这一特点有助于鉴别诊断,我们根据病变起源于消化道壁的哪层结构来判断黏膜下肿物的组织来源,例如,胃肠间质瘤多位于超声第四层结构内,而脂肪瘤多位于超声第三层结构内 [6] 。
(三)病变的累及范围
多年来大量的研究表明,病变累及的实际解剖范围与EUS显示的范围基本是一致的,所以EUS对恶性肿瘤分期的准确率较高(80%~90%)。
(四)区分病变良恶性
根据病变的声像图特点,EUS可帮助区分良恶性病变。恶性病变更易于破坏消化道壁的五层结构,可出现消化道超声第四层结构的增厚。此外,在EUS引导下,对消化道微小病变钳取活组织或细针吸取细胞学检查,能明显提高取材的阳性率,对确定良恶性病变的性质大有帮助。而且在EUS的引导下进行的深挖活检(deep biopsy)可避免并发症的发生。
我们相信,随着高分辨率的EUS技术不断完善,超声探头更易于清晰显示消化道壁的结构 [7,8] 。有时可以将消化道壁显示为7层、9层,甚至更多层结构。将其用来显示固有层和黏膜深层,有助于早期癌的精确分期,会有更广阔的应用前景。
(王晟 孙思予)
参考文献
1.Bolondi L,Caletti GC,Casanovap P,et al.Problems and variations in the interpretations of the ultrasound features of the normal upper and lower GI tractwall.Scand JGastroenterol,1986,21(suppl 123):25.
2.Bolondi L,Casanova P,Santi V,et al.The sonographic appearance of the normal gastric wall:An in vitro study.Ultrasound Med Biol,1986,12:991-998.
3.Kimmey MB,Martin RW,Hagitt RC,etal.Histologic correlates of gastrointestinal ultrasound images.Gastroenterology,1989,96:433-441.
4.Odegaard S,Kimmey MB,Martin RW,et al.The effects of applied pressure on the thickness,layers,and echogenicity of gastrointestinal wall ultrasound images.Gastrointest Endosc,1993,39:499-504.
5.Pellicano R,Bruno M,Fagoonee S,et al.Endoscopic ultrasound in the preoperative staging of gastric cancer:key messages for surgeons.Minerva Chir,2015,70(6):417-427.
6.Guo J,Liu Z,Sun S,et al.Endosonography-assisted diagnosis and therapy of gastrointestinal submucosal tumors.Endosc Ultrasound,2013,2(3):125-133.
7.Wiersema MJ,Wiersema LM.High-resolution 25-megahertz ultrasonography of the gastrointestinal wall:histologic correlates.Gastrointest Endosc,1993,39:499-504.
8.Murata Y,Suzuki S,Ohta M.Small ultrasonic probes for determination of the depth of superficial esophageal cancer.Gastrointest Endosc,1996,44:23-28.