第三节
羟基化合物的检验
一、一般醇羟基的检验
(一)金属钠实验
方法 在一干燥的微量试管中加入2滴液体试样,用玻勺取数颗钠粒放入试管中。若钠粒表面不断有气泡产生即表示正性结果。
钠粒的制备 在一个带有磨口塞的锥瓶中放入一小块金属钠,加适量的甲苯或二甲苯使有机液体将钠盖住。在石棉网上用火直接加热至甲苯沸腾,并且有机蒸气上升至距瓶口一半距离时为止,这时金属钠融化成液体。盖上玻塞,立刻用毛巾包裹锥瓶极力摇荡,并不时将瓶塞轻微打开令空气进入,以免有机液体冷却时将瓶内造成真空致瓶塞难以打开。制得的钠粒直径约0.5mm即可使用,储藏在二甲苯中(操作时必须戴护目镜!)。
注意事项 这个方法鉴定C 3 ~C 8 范围的醇类最为有用。无水低级醇不易制备,稍受潮湿即与钠发生作用,但是由于它们具有羟基,能继续与Na作用生成白色胶冻状醇钠,借此仍可以识别出来。高级醇与钠作用太迟缓,较难识别。
凡含有活泼氢的化合物,如酸、酚、伯胺与仲胺、硫醇、甲基酮以及活泼亚甲基化合物对此试剂均呈正性反应。
(二)硝酸铈实验
大多数能溶于水的羟基化合物,遇硝酸铈溶液,都能够生成琥珀色或红色的配合物。

方法 溶解25~30mg试样于2mL水(或1,4-二氧六环)中,加入0.5mL硝酸铈试剂,摇荡后观察溶液颜色的变化。呈红色者,为正反应,表示有醇羟基存在。
试剂制备 将90g硝酸铈铵Ce(NH 4 ) 2 (NO 3 ) 6 溶于225mL2mol/L温热的硝酸中。
注意事项
①醇类、邻二醇类、羟基酸、羟基酯以及羟基醛酮,其碳原子数不超过10者,均能与试剂发生显色反应,呈现亮黄色至琥珀色,橙黄色或红色。氨基酸一般无颜色反应而是产生氢氧化铈沉淀。
②许多酚类在水溶液中与本试剂反应产生棕绿色或棕色沉淀,在1,4-二氧六环中产生棕红色或棕色沉淀。
③芳胺与噻吩类及易被氧化的化合物遇试剂产生各种颜色,以致对实验有干扰。
(三)酰氯实验
酰氯与羟基化合物作用,形成酯。酯在水中的溶解度比原来的羟基化合物小,容易分层析出。且低级醇的酯往往易于挥发,具有水果香味,可以此鉴别:

方法
①乙酰氯法 将50~100mg试样放入一中型干燥试管中,加入3滴乙酰氯,放置3min。如果无反应发生,将试管温热2min,并加入2mL水,用少量固体碳酸钠饱和水层,观察,并闻一下是否具有水果的香味。
②苯甲酰氯法 于一试管中加入50mg试样、3滴苯甲酰氯及1mL 10%氢氧化钠溶液,塞紧管口,将试管极力摇荡。用石蕊试纸检验反应液,如果不呈碱性,再加入少许10%氢氧化钠溶液,再摇荡。溶液呈碱性后,注意观察发生的现象,并注意闻气味。
注意事项:
①酰氯在上述条件下也能与伯胺或仲胺反应形成酰胺,但没有香味:
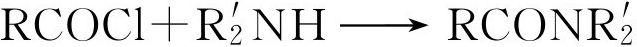
②叔醇与酰氯反应时,主要产物是卤代烷,它是难溶于水的液体,容易被误认为是酯类,为了避免卤代烷的生成,在叔醇酰化前,可以加入2滴 N , N -二甲基苯胺。使反应中产生的氯化氢与之结合成铵盐。
③高级醇及酚类与酰氯反应较缓慢,实验时采用苯甲酰氯法法较适宜。
④低级脂肪醇的酯易溶于水,为了使它们自水中析出,可在溶液中加入少量固体碳酸钠或碳酸钾,进行盐析,使其浮于液面。如果酯的形成不易从外表现象观察出来时,可将产物进行羟肟酸盐实验。
(四)黄原酸盐实验
在室温下,有碱金属氢氧化物存在时,伯醇和仲醇均能迅速与二硫化碳反应生成水溶性的烃基代黄原酸盐:
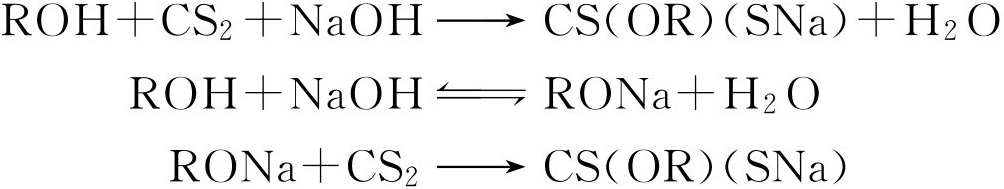
所有烃基代黄原酸盐均与含有过量无机酸的钼酸铵溶液反应形成紫色产物。紫色产物的组成是MoO 3 ·2CS(OR)SH,能溶于有机溶剂,如苯、二硫化碳、乙醚、氯仿中,因此可以用这个方法检验伯醇与仲醇。
方法 取1滴试液(如果可能,取乙醚溶液)放入1支干燥试管中,同时加入1滴二硫化碳及数十毫克粉状氢氧化钠。摇荡试管约5min,加入1或2滴1%钼酸铵溶液。当氢氧化钠刚好溶解时,立刻用2mol/L硫酸小心将溶液中和,加入2滴氯仿,再摇荡。若试液中有伯醇或仲醇存在时,氯仿层显紫色。
注意事项
①黄原酸-钼酸铵法检验醇不是很灵敏的,因为醇或醇化物转化为烃基黄原酸盐的反应不是定量地进行。而且,当黄原酸盐溶液酸化时,即使在钼酸铵存在下,仍然不可避免地有部分黄原酸分解,重新析出CS 2 及ROH。
本法能检验出各种醇的量如下:
1.0mg甲醇 0.5mg异戊醇 1.0mg丁醇
1.0mg乙醇 1.0mg丙烯醇 1.0mg异丁醇
1.0mg丙醇 0.5mg环己醇 0.1mg苯乙醇
②酯也能如醇一样地进行反应,因为在检验条件下,它们能部分地皂化析出醇。含有CH 2 COCH 2 基团的化合物也能与CS 2 及碱金属氢氧化物作用,形成橙红色化合物,后者在用钼酸铵处理时产生棕色沉淀,该沉淀不溶于氯仿中,所以它们对用此法检验少量醇时有干扰。
(五)钒-8-羟基喹啉实验
8-羟基喹啉钒化合物(A)为黑绿色,溶于苯、甲苯等中呈灰绿色溶液。当加入醇后,溶液变为红色,可能是由于发生了溶剂化,产生了如(B)所示的产物。利用这个反应检验醇羟基。
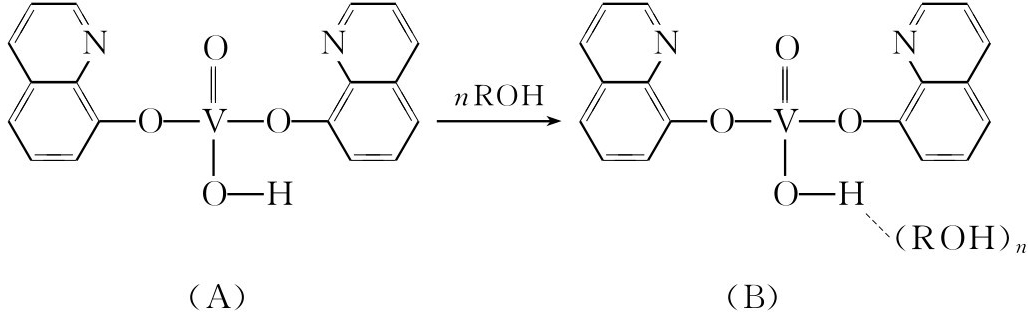
方法 将1滴试液(溶于水、苯或甲苯中)放入一小试管中,加入4滴溶于苯或甲苯中的8-羟基喹啉钒灰绿色溶液。将混合物在不时摇荡下放入60℃水浴中温热,在2~8min后颜色转变为红色,表明有醇羟基存在。在进行少量醇样品检验时,可进行空白对照实验,以资比较。
试剂 8-羟基喹啉钒化合物的苯溶液配置:将含有1mg钒的溶液1mL用1mL2.5%的8-羟基喹啉溶于6%乙酸中的溶液处理。将混合物用30mL苯摇荡萃取。所得溶液能保存约一日之久。
注意事项 一般醇类都能用这个方法检验出来,但有些含羟基的化合物,如糖类、甘油等无此反应,可能是由于它们不溶于苯的缘故。除了含醇羟基外,还含有羧基或碱性氮原子、酚羟基的化合物,如乳酸、酒石酸、柠檬酸、苦杏仁酸及胆碱氢氯酸盐等均无此反应;能溶于苯的黄料母醇也无此反应;硫醇与胺类产生绿色或黄色变化。
(六)高锰酸钾-2,4-二硝基苯肼实验
伯醇与仲醇能被氧化成为羰基化合物,再使后者转化为2,4-二硝基苯腙来鉴定。叔醇无此反应。
方法 取4~5滴试样放入一中型试管中,加入5mL高锰酸钾溶于2mol/L硫酸中的饱和溶液。将混合物摇荡2~3min,伯醇与仲醇被氧化成为醛或酮,高锰酸根离子被还原成二氧化锰(棕色沉淀)。加入足量的乙二酸使二氧化锰溶解,以及使过量的高锰酸根离子还原,溶液变澄清。然后加入2,4-二硝基苯肼试剂。这时,或者加入5mL水以后,若有2,4-二硝基苯腙沉淀析出,表示正性结果。得到的腙衍生物可以过滤,自乙醇中重结晶,测定熔点以鉴定由醇氧化所产生的羰基化合物。
注意事项 在进行检验前,必须确定原来样品不是一个羰基化合物。本检验不能检出叔醇,也不能检验出高分子量的醇类,因为它们在氧化时反应进行太慢。当然,任何易被氧化的化合物都能被还原高锰酸根离子,因此,实验结果必须有能与2,4-二硝基苯肼缩合的羰基化合物产生,方能证明醇的存在。
(七)碘酸实验
简单的C 2 ~C 7 醇类(甲醇例外)能被碘酸氧化,碘酸本身被还原,析出棕红色的游离碘,可以鉴定羟基的存在:
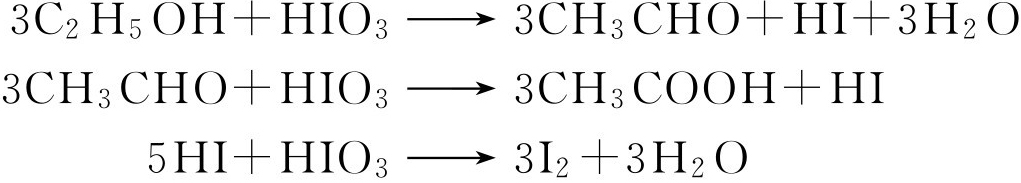
除醇类外,醛类、甲基酮类、酚类与苯胺衍生物均有反应,而某些含羟基的化合物如多元醇(1,2-丙二醇及1,3-丙二醇例外)、糖类(戊糖、果糖与蔗糖例外)等却无此反应。
方法 小心将2.5mL浓硫酸加到8mL水中,冷至室温,加入100mgKIO 3 。在其中加入50mg试样,将反应试管浸入沸水液中1h(若氧化反应迅速发生则不必加热如此之久)。如有棕色碘析出,表明是正性结果。
(八)硝基铬酸实验
硝酸与重铬酸钾的混合物能氧化大多数伯醇和仲醇,产生蓝色反应。此外,糖类、甲醛、乳酸及酒石酸等均有此反应。
方法 取5滴5% K 2 Cr 2 O 7 溶液加到5mL冷却的7.5mol/L硝酸中,加入1mL 10%的样品水溶液(若样品不溶于水,取50~100mg样品直接加入),摇匀。若在5min内有鲜明蓝色出现,表明是正性结果。
二、酚类的检验
(一)溴水实验
酚类能使溴水褪色,形成溴代酚析出:
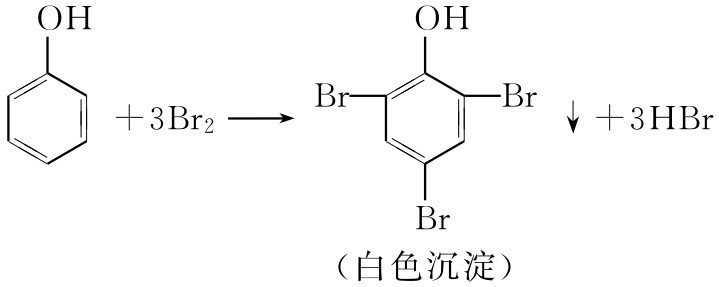
方法 于20~25mg试样的水溶液或悬浮液中,逐滴加入饱和的溴水溶液,直到溴的棕色不再褪去为止。若试样能消耗溴水溶液,有时还伴有白色沉淀生成,表明是正性结果。
注意事项 一切含有易被溴取代的氢原子的化合物,以及一切易被溴水氧化的化合物,都有这个反应。
(二)三氯化铁实验
大多数酚类、烯醇类遇三氯化铁均能形成有色络合物。
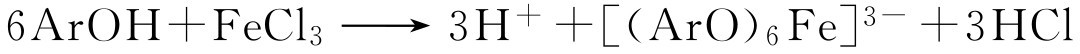
方法:
①水溶性酚。溶解40~50mg化合物于1~2mL水中,或水与醇的混合溶剂中。加入3滴2.5%的三氯化铁水溶液,注意溶液的颜色变化或沉淀的生成。
②非水溶性酚。溶解30mg试样于1~2mL氯仿中。加入1~2滴按下法配成的试剂溶液。溶解1g三氯化铁于100mL氯仿中,加入8mL吡啶,将混合物过滤,所得滤液即为试剂。将观察结果与①法所进行的实验结果加以比较。
实践表明,如果将操作步骤改变如下,有时可以得到更明显的结果。
先配成氯仿的三氯化铁饱和溶液。将此溶液与试样混合,如果无显色反应,那么倾斜地持着试管,沿管壁滴入1滴吡啶,若交界面上立即有颜色环生成,表明是正性结果。
注意事项 大多数酚与三氯化铁反应产生红、蓝、紫或绿色反应。颜色随所用溶剂、试剂浓度、反应与观察时间之间隔长久以及pH值等的不同而改变。在非水溶液(氯仿)中,并有一个弱碱(吡啶)存在下进行这个反应时,反应灵敏度提高许多,并且使那些在水溶液中实验时呈负性结果的酚类,也能被检验出来。吡啶所起的作用可能是当作一种质子接受者,增加了酚基负离子的浓度。大多数硝基酚类、氢醌、愈疮木酚、间位和对位羟基苯甲酸及其酯类以及2,6-二叔丁基对甲苯酚均显负性结果。
脂肪族羟基酸与三氯化铁反应,产生鲜明的黄色溶液。许多芳香酸类产生褐色沉淀(五倍子酸产生黑色沉淀),烯醇类通常产生褐色、红色或红紫色;肟,如果它们显正性结果的话,如亚磺酸类一样,通常反应后显示红色。羟基吡啶及羟基喹啉产生红、蓝或绿色。
羟肟酸与三氯化铁反应产生蓝红色,或紫色,或猩红色。
(三)亚硝酸实验(李伯曼实验)
酚类与亚硝酸作用形成对-亚硝基衍生物,后者再与过量的酚作用形成靛酚。靛酚是酸碱指示剂,在酸性与碱性介质中有不同的颜色变化,可以检验酚类。反应如下:
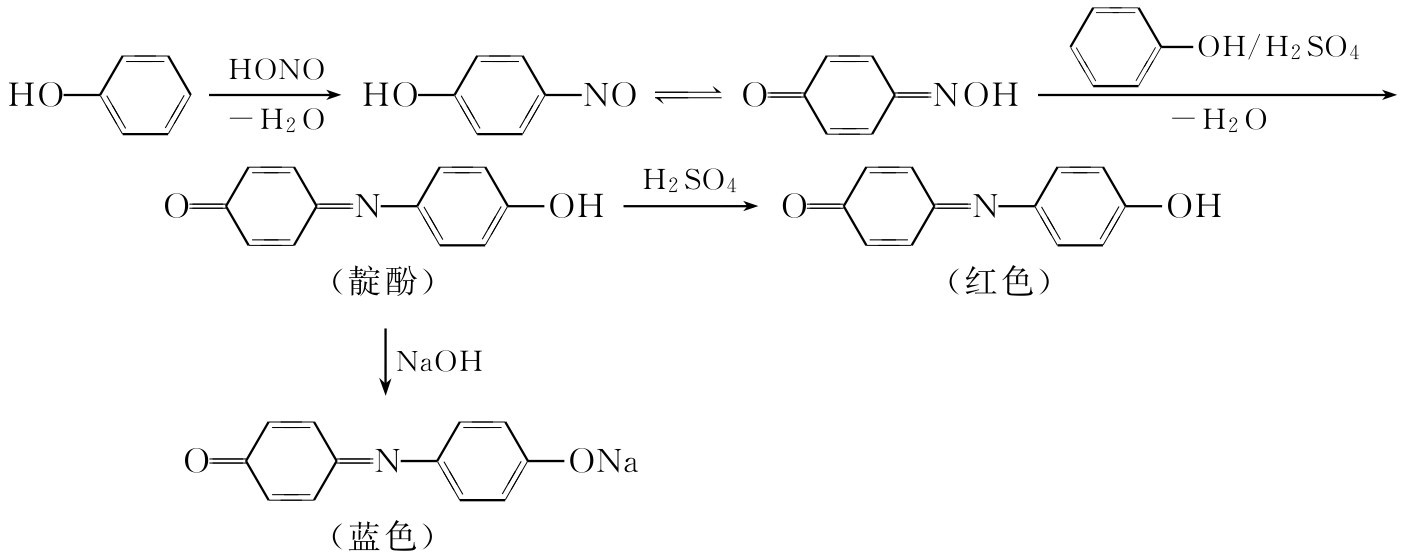
方法 取约50mg试样,放入盛于 ф 10mm×100mm试管内的1mL浓硫酸中,加入约20mg亚硝酸钠,摇荡试管并温热。若呈现绿色、蓝色或紫红色,表明正性结果。将混合物小心倒入5mL水中,颜色往往变为红或蓝红色。加入20%氢氧化钠溶液,直到混合物呈碱性为止。所得到的碱性溶液一般变为蓝色或绿色。
注意事项 硝基酚类及对位取代的酚类均显负性结果。在二羟基苯酚类中,只有间苯二酚显正性结果。
如果样品很少,按下法实验:取几毫克样品放于白色点滴反应板上,用毛细吸液管吸取1~2滴浓硫酸加在样品上。用玻璃棒搅拌,直到样品溶解。用刮匙尖挑取1~2颗亚硝酸钠晶体,加到所得的硫酸溶液中,逐渐有蓝绿色或红紫色出现(亚硝酸钠不可以加得太多,否则颜色变为深黑,不易观察)。一边搅拌一边滴入4~5滴水,这时颜色往往有变化。如再用20%的氢氧化钠溶液将所得到的混合液加以碱化,颜色又有变化。
在这个实验中,是先使一部分酚试样亚硝基化,再让所产生的亚硝基酚与未反应的酚发生缩合作用形成靛酚。另外,若事先用一种亚硝基酚作试剂,直接与酚试样发生缩合反应也是可以的。这样,在某些情况下,可以提高实验的灵敏度。常用的亚硝基酚试剂是5-亚硝基-8-羟基喹啉。操作手续是:取一滴试样的醇溶液或碱性溶液在微坩埚中蒸干,冷却后加入一滴试剂(1%的5-亚硝基-8-羟基喹啉溶于浓硫酸的溶液)。温热后若有靛酚染料生成,表明正性结果。
(四)氨基安替比林实验
在碱性溶液中,用铁氰化钾作氧化剂,首先使酚氧化成醌,再与4-氨基安替比林缩水生成红色的安替比林染料。
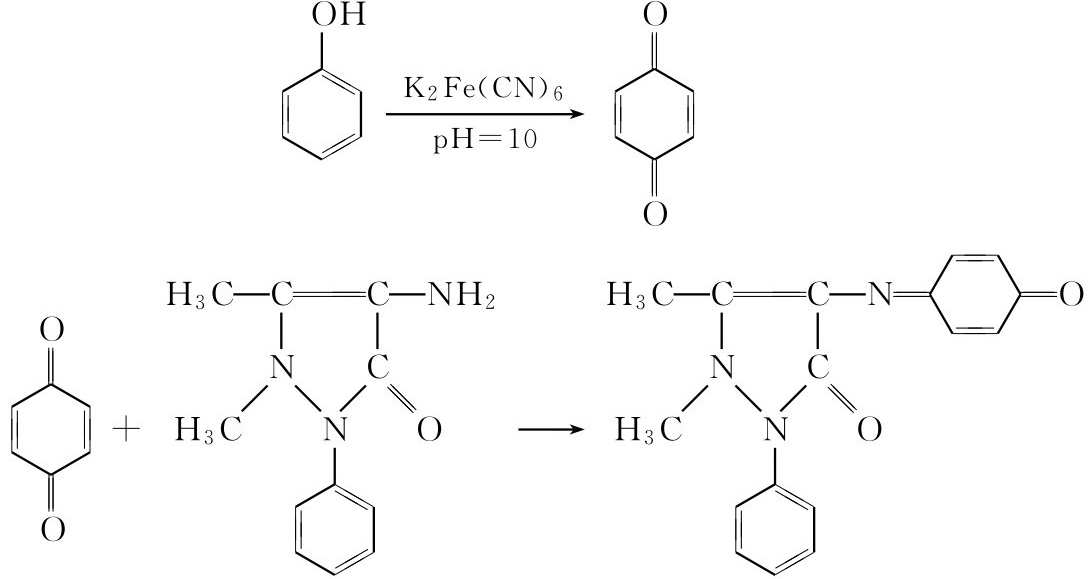
方法 将0.1g样品溶于3mL水(或甲醇)中,加2滴3% 4-氨基安替比林溶液和5滴1%的碳酸钠溶液后,再加5滴8%的铁氰化钾溶液。混合后,溶液显红色、紫色或橙色者,表示正结果,呈黄色者为负结果。
本实验不仅用作酚类的检验,也用于污水中苯酚的比色定量测定。
4-氨基安替比林在碱性溶液中,有铁氰酸根存在时,能将多数酚类氧化成醌型的化合物,铁氰化钾溶液加入前,溶液必须呈弱碱性(pH=10),否则其他类型的有机化合物,也会在中性或酸性介质中产生颜色。
酚的对位若具有下列取代基:R—、Ar—、—NO、—NO 2 、—ArCO、—CHO、—CN,则产生的颜色很淡,或显负性反应。其中硝基处于邻、对位时,会阻止反应,如果硝基在间位时,则对反应影响不明显。
酚的对位若有下列取代基:—OH、—SH、—X、—COOH、—SO 3 H、—OR,则不影响反应的进行,仍得正结果,因为这些基团在反应时被取代。
α -萘酚、5-羟基喹啉和8-羟基喹啉反应后得到红色,而 β -萘酚,3-羟基喹啉,6-羟基喹啉和7-羟基喹啉反应后却呈绿色。
对位没有取代基的芳香胺类化合物对此有干扰现象。


