第六节
羧酸及羧酸衍生物的检验
一、羧酸的检验
羧酸的酸性可直接由溶解度实验和指示剂实验来检出,对直接不易检出的羧酸也可根据羧酸酸性强弱的不同,采用碘酸钾-碘化钾溶液来鉴定。此外,测定羧酸的中和量可先使羧酸转变为衍生物后,用羟肟酸铁实验来进行间接检验。
(一)碘酸钾-碘化钾实验
羧酸与碘酸钾-碘化钾溶液混合后,温热能析出碘,碘遇淀粉溶液则呈蓝色。
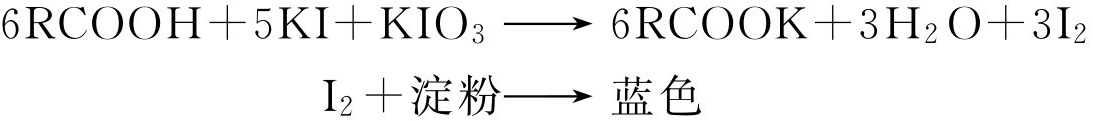
方法 取5mg试样(或2滴其在中性乙醇中的饱和溶液)置于小试管中,加入2滴2% KI溶液及2滴4% KIO 3 溶液。塞好试管,置沸水浴中加热1min,冷却,加入1~4滴0.1%淀粉溶液。若样品为酸性,则呈现蓝色。
在某些情况下需要多加一些淀粉溶液方能出现碘-淀粉复合物的特征蓝色。
固体试样可取数毫克与数毫克干燥的KI及KIO 3 共同研细。若有碘的棕色出现即表明正性结果。如果对判断发生怀疑,可在混合物中加入5滴水及2~4滴淀粉溶液再进行观察。
(二)中和量的测定
羧酸能被标准的氢氧化钾溶液中和,据此可以求出羧酸的中和量。中和量是指每摩尔OH-可以中和羧酸的克数。
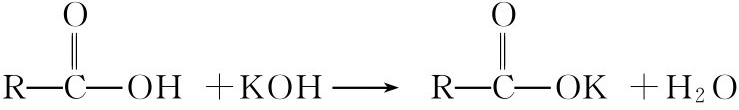
一种羧酸的中和量乘上羧酸分子中羧基的数目,其乘积即为该羧酸的分子量。
方法 准确称取试样0.2000g,置于250mL的锥形瓶中,加水或水与乙醇的混合溶液20mL,使试样溶解,加2滴酚酞作指示剂。再用0.1mol/L的氢氧化钾标准溶液滴定至终点。
测定完后,按下列公式计算羧酸试样的中和量。
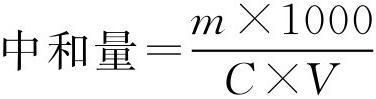
式中, m 为试样的质量,g; C 为氢氧化钾物质的量浓度,mol/L; V 为滴定时用去氢氧化钾标准溶液的体积,mL。
一般的羟基,不影响中和量的测定,例如水杨酸的中和量,等于它的分子量。而脂肪族 α -氨基酸不能用本法来测定其中和量。
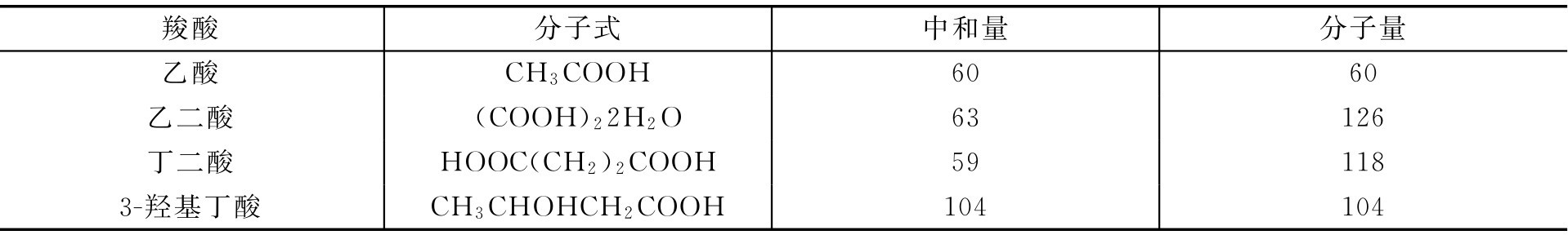
几种典型羧酸的中和量和分子量的关系如表3-2所示。
表3-2 几种典型羧酸的中和量和分子量的关系
不溶于水及乙醇的羧酸,称量后可以先加入定量的过量氢氧化钾标准溶液,加热煮沸,冷却后,再用标准酸溶液来滴定过量的碱。
(三)羟肟酸铁实验
羧酸不能直接与羟胺作用,需将羧酸转变为酰氯后再转变为酯,后者与羟胺作用形成羟肟酸。羟肟酸与三氯化铁在弱酸性溶液中形成有颜色的可溶性羟肟酸铁。大多数这样的铁盐呈现紫红色,但通常也呈深蓝色,尤其当浓度很大时更是如此。反应如下:
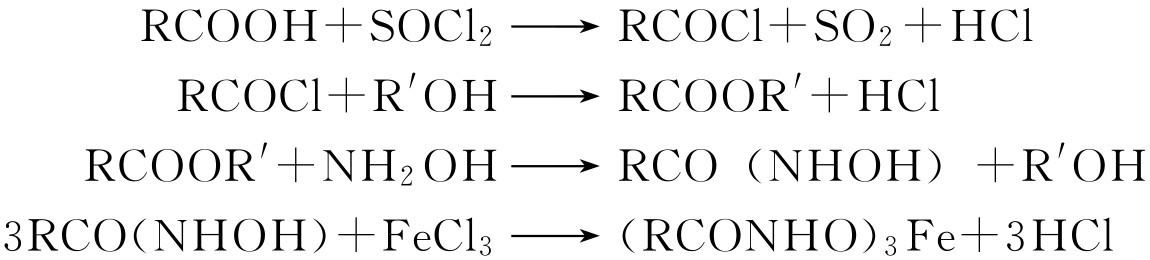
方法 放100mg(或4~5滴)试样于一中型试管中,加入6滴氯化亚砜。将试管浸入沸水浴中加热,使混合物沸煮2min。再加入1mL正丁醇,再沸煮1min。若有沉淀出现,再逐滴加入丁醇,并继续加热直到沉淀溶解为止。将试管冷却,加入1mL水使过量的氯化亚砜水解,加入1mL 1mol/L盐酸羟胺溶液,然后加入足够量的5mol/L氢氧化钾溶于80%乙醇的溶液,使混合物对石蕊试纸呈碱性反应。将混合物加热至沸,再冷却。以稀盐酸将所得反应混合物酸化,然后逐滴加入10%三氯化铁溶液,若有紫红色或紫红色出现,即表明正性结果。
注意事项 通常加1或2滴三氯化铁溶液即足以出现羟肟酸铁盐的颜色。然而,在某些情况下加入的量需要多一些,直到加入的量已超过1mL尚不显色时方可算负性结果。如果有大量酯存在,加入三氯化铁后呈现红棕色。这样的混合物如果用水稀释,一般能显现特征的紫红色。
所有酰卤、酸酐和酯类对本实验都能给出正性结果。这些化合物可以借元素分析(如酰卤含有卤素)、溶解行为(这些化合物均属中性)等实验与羧酸区别开来。
氯化亚砜与二元羧酸作用形成酸酐而不是酰氯,尤其如HOOC(CH 2 ) n COOH,当 n 是2或3时则形成酸酐,当 n 等于4或5时则形成环状酮类。二氯乙酸及三氯乙酸以及氨基酸与氯化亚砜作用不形成酰氯, α -羟基酸与氯化亚砜作用产生甲酸及一个醛或酮, α , β -不饱和酸遇氯化亚砜,与析出的氯化氢发生加成反应形成 β -氯代酸。
将羧酸转变为酯的另一方法是:溶解或悬浮20~25mg试样于0.5mL乙二醇中。加入1滴浓硫酸,缓和回流加热2min。冷却,进行上述羟肟酸实验。
二、酰卤的检验
酰卤含有活泼的卤素。低分子量的酰卤遇水易水解,溶液呈酸性反应,遇碱溶液水解更快。酰卤能借羟肟酸铁实验检出,也可借下述实验检验。
苄胺实验 酰卤与苄胺反应产生不溶于水的酰苄胺沉淀。
方法 在小型试管中盛3滴苄胺,加入2滴试样。当反应缓和后,加入2mL冷水,并极力摇荡试管,产生的白色沉淀可自水中重结晶,测定其熔点。
三、酯的检验
鉴定酯的最好方法是羟肟酸铁实验。
四、酸酐的检验
大多数酸酐可以直接转化为羟肟酸而进行检验,无需先将它们转变为酯:

方法 将1滴酸酐加到0.5mL 1mol/L盐酸羟胺的甲醇溶液中。将混合物加热至刚好沸腾,冷却,加入1滴10%三氯化铁溶液。有羟肟酸铁络合物的特征颜色(蓝红色)出现时,表明正性结果。
若事先推测试样可能是一个酸酐,但按上述操作给出负性结果时,那么将3滴试样与3滴丁醇共热,然后按酯类进行检验。
五、酰胺的检验
(一)羟肟酸铁实验
凡在氮原子上没有取代基的酰胺,均可借羟肟酸铁实验来检验。当然,必须事先知道试样中不再含有其他能起羟肟酸盐反应的官能团。
方法 将20~25mg试样加到1mol/L羟胺盐酸盐在1,2-丙二醇(Propylene Glycol)的溶液中。煮沸加热2min,冷却,加入0.5~1mL5%三氯化铁溶液,如有红到紫色显现,表明正性结果。
(二)区别芳香酰胺与脂肪酰胺的实验
大多数芳香酰胺能借过氧化氢处理直接转变为羟肟酸,而脂肪酰胺则不行。大多数脂肪酰胺与羟胺的水或醇溶液作用能转变为羟肟酸,而芳香酰胺在同样实验条件下的反应则要缓慢得多:
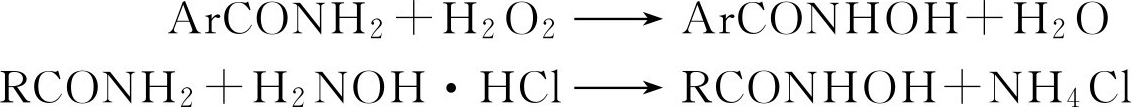
方法
①脂肪酰胺的检验 将40~50mg酰胺加到1mL 1mol/L羟胺盐酸盐的乙醇溶液中,将混合物沸煮3min。冷却,加入1~2滴5%三氯化铁溶液,有蓝红色显现则表明正性结果。
②芳香酰胺的检验 悬浮40~50mg试样于2~3mL水中,塞好试管并且将它极力摇震数秒钟。加入4~5滴6%过氧化氢溶液,将混合物加热接近沸腾。如果酰胺尚未完全溶解,再多加数滴过氧化氢溶液。冷却,加入1滴5%三氯化铁溶液。如果在1min之内尚无蓝红色显现,需将试管加以温热,但不使溶液沸腾。在大多数情况下,反应往往经过羟肟酸盐阶段,出现棕色,逐渐析出棕色沉淀。
在上述实验最后所得到的混合物中加入数毫升10%氢氧化钠溶液,可得到澄清的深红棕色沉淀。
(三)酰胺水解实验
N-取代的或未取代的酰胺,也可以借水解生成胺及羧酸的方法加以鉴定。
(四)脲、取代脲及硫脲实验
脲与取代脲在性质上近似于酰胺。当脲、N-取代脲或N,N'-二取代脲与过量苯肼在200℃时加热时,得到均二苯氨基脲(Diphenyl Carbazide),并析出氨或胺。例如:

硫脲则生成二苯氨基硫脲。均二苯氨基脲或均二苯氨基硫脲与镍离子反应形成紫色螯合物,此产物能溶于氯仿。
方法 将20~25mg试样置于一中型试管中,加入2~3滴苯肼,将混合物置油浴中于195℃加热5min。冷却,加入6滴浓氢氧化铵及6滴10%硫酸镍溶液。极力摇荡试管,静置3min。用10滴氯仿萃取混合物。若氯仿层显红紫或紫色,表明正性结果。
注意事项 在反应温度下,部分脲转变为缩二脲。不过缩二脲也与苯肼反应产生均二苯氨基脲。许多氨基甲酸酯用这个方法检验,也得正性结果。这个实验的灵敏度,在用于检出脲时比用于检出硫脲时更高。硫脲的存在,可借在200℃时加热干燥样品使生出H 2 S的办法来检出。


