第十章
|
|
|
|
内镜超声的弹性成像技术
EUS引导下细针吸取细胞学检查(EUS-FNA)现已成为临床上一种对消化道及邻近疾病进行鉴别诊断或分期的较为成熟的微创技术 [1-3] 。然而,EUS-FNA对操作的技术水平有着较高的要求,会有一些假阴性结果,且EUS-FNA为有创性检查,有可能出现出血、感染、肿瘤破裂 [4,5] 等并发症。另外,在临床工作中,有一部分患者不愿意或不适合进行EUS-FNA,因此近年来临床上尝试开展了一些新技术,如EUS弹性成像、造影增强EUS检查等以提高EUS影像学对病变良恶性判断的准确性 [6-10] 。
超声弹性成像是近年来应用于临床的无创性操作技术。一些病理进程,如炎症、纤维化、恶性肿瘤等都会导致组织硬度改变,通过探头对邻近消化道的生物组织加压使其变形,由于组织的弹性及软硬度存在差异,在相同压力作用下,质地柔软、弹性大的组织加压后恢复快,质地硬、弹性小的组织加压后恢复慢,这种因加压变形所产生的组织位移速度差异经量化分析后转化为不同的彩色图像,弹性大的组织显示为红色,弹性小的组织显示为蓝色,弹性系数中等的组织显示为黄色、绿色,从红色至蓝色的渐变代表组织质地从软到硬 [10-14] 。有实验研究结果表明,实时组织弹性成像能较有效分辨不同硬度的物体,但其所反映的并不是被测体的硬度绝对值,而是与周围组织相比较的硬度相对值 [15] 。
EUS弹性成像在获得组织常规超声影像的同时,通过对其弹性系数(软硬度)判断,可应用于良恶性淋巴结及胰腺或肝胆局灶病变的鉴别 [16-22] ,且对于胃肠道及其周边实体性肿瘤的发现与鉴别亦有帮助 [23] 。EUS弹性成像还可用于指导诊断性活检,以减少不必要的为了明确组织性质而进行的EUS-FNA [24] 。
一代EUS弹性成像技术为定性弹性成像技术,二代EUS弹性成像技术可以半定量及定量分析组织的硬度。定性弹性成像的缺点在于,结果受操作者的主观性影响较大,而半定量及定量弹性成像的优势在于可以算出具体的数值,减少了主观影响,客观性较强。
一、EUS定性弹性成像
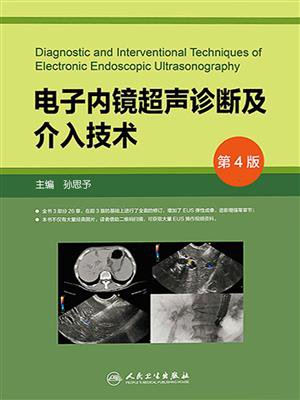
定性弹性成像根据B模式灰阶图像下组织压缩变形的量化作为组织硬度的指标。弹性(在1至255范围内)使用色彩映射(红-绿-蓝),其中,较硬组织呈深蓝色,中等硬组织呈青色,中间硬度组织显示为绿色或黄色,较软组织呈红色。通常使用双面板图像用于对比演示,左侧为弹性成像图像,右侧为常规超声图像(图10-1)。
手动选择感兴趣区域(region of interest,ROI)为弹性成像评价区域。将ROI覆盖整个靶病变,以及一些周围组织以供参考。一种图像至少稳定5秒钟以确定最终颜色图案,避免颜色出现波动。
弹性成像最早应用于体表超声,包括五分法和七分法,可以帮助判断表浅器官如乳腺、甲状腺、淋巴结等的良恶性。2006年,Giovannini等 [24] 借鉴了体表超声弹性成像,首次报道了EUS结合定性弹性成像技术在淋巴结及胰腺肿块诊断中的应用,结果显示对恶性肿瘤检测的敏感度和特异度分别为100%和67%。该研究中建立了评分标准:1分:均一的软组织(绿色),为正常组织;2分:不均一软组织(绿色,黄色和红色混合),为纤维化或炎症;3分:软硬混合组织(混合色)或蜂窝状弹性成像,可疑恶性肿瘤;4分:病变硬(蓝色),中心区域较软(绿色),考虑为恶性或富血管病变;5分:病变以硬组织为主(蓝色),散在较软区域(绿色,红色),考虑为晚期恶性病变伴有坏死区。Giovannini等 [25] 在随后的多中心临床试验中应用EUS弹性成像技术对121例胰腺肿块及101例淋巴结进行评估,得到了较高的准确性。之后,多位国内外专家 [20,26-28] 研究报道,EUS弹性成像对胰腺良恶性病变、淋巴结良恶性判断有较高的敏感度及特异度。
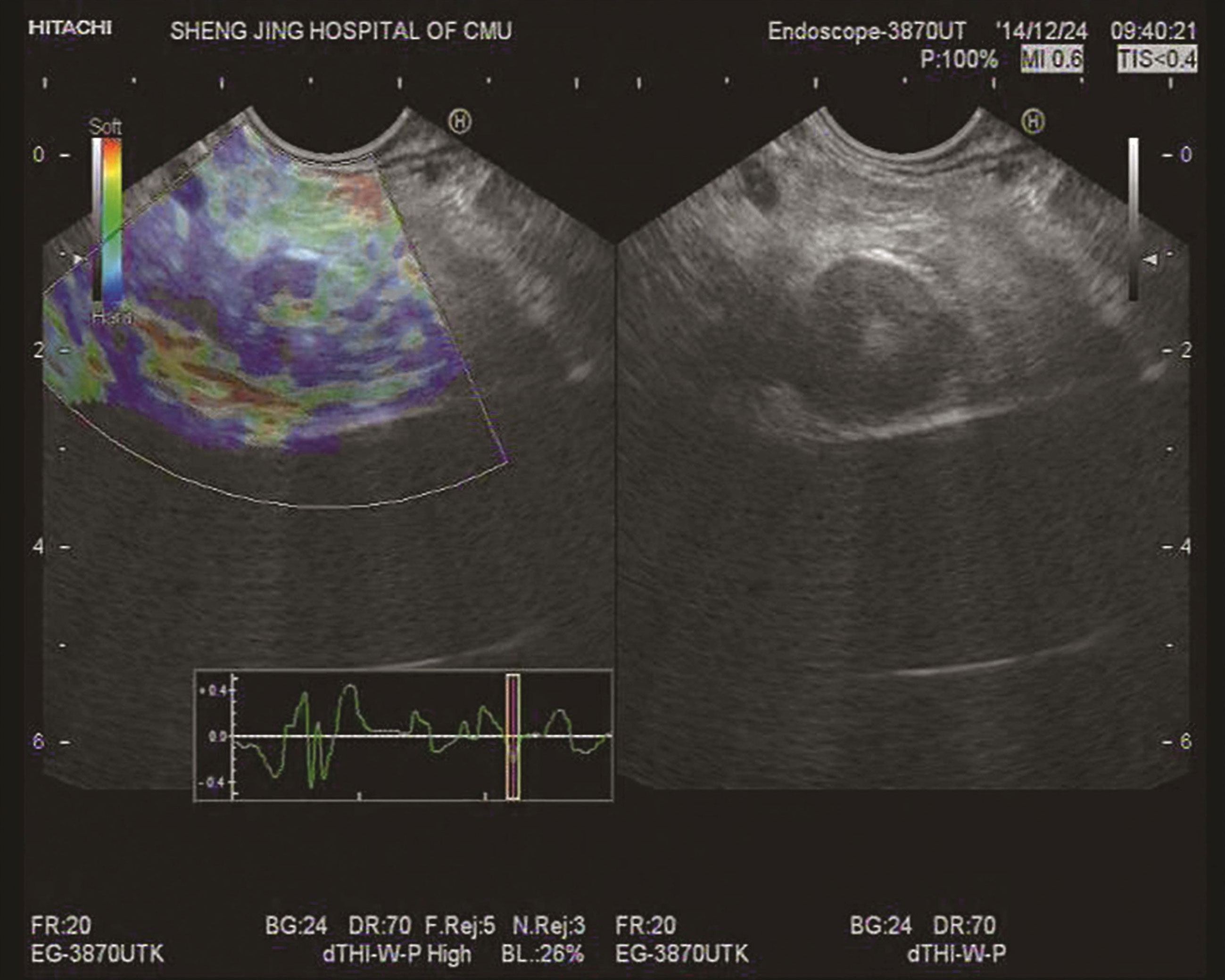
图10-1 EUS弹性成像
由于定性弹性成像受操作者主观因素影响较大,产生的应变与位移可因施加压力的大小不同而不同,也可因压、放的频率快慢而不同,因此,半定量及定量弹性成像应运而生,在一定程度上提高了客观性。
二、EUS半定量及定量弹性成像
(一)应变率比值法(strain ratio)
应变率的计算是基于标准定性的EUS弹性成像数据。首先应用B模式灰阶成像对患者进行常规EUS检查,了解病变部位、大小、形态及内部回声。选取两个不同的区域(A和B)用于弹性成像分析。区域A在病变区域内选择,要尽可能多的包含靶病变,尽可能不包括周围的组织。区域B选取病变以外的较软组织,即弹性成像下显示为红色的区域,计算B/A的比值,即为应变率比值。为保证准确性,超声弹性成像影像稳定至少5秒后再进行分析。
Iglesias-Garcia等 [29] 应用应变率比值法对胰腺实质性肿块进行了评价,并得出结论,几种胰腺肿块的应变率比值分别为:正常胰腺组织:1.68(95%CI 1.59~1.78);炎性肿块:3.28(95%CI 2.61~3.96);胰腺癌:18.12(95%CI 16.03~20.21);胰腺内分泌肿瘤:52.34(95%CI 33.96~70.71)。 该研究认为,在使用cut-off值为6.04时,该方法敏感度达100%,特异度达92.9%,应变率比值>15.41评估胰腺实性占位为恶性的准确率为100%。Iglesias-Garcia等 [30] 应用应变率比值法诊断慢性胰腺炎的研究中,将178位患者根据Rosemont标准分组,结果显示应变率比值在不同分组中有显著统计学差异( P <0.001):正常胰腺1.80(95%CI 1.73~1.80);可疑慢性胰腺炎2.40(95%CI 2.21~2.56);提示慢性胰腺炎2.85(95%CI 2.69~3.02);符合慢性胰腺炎3.62(95%CI 3.24~3.99)。
Iglesias-Garcia等 [31] 在最近的一项前瞻性研究中对191例已知慢性胰腺炎或原因不明的上腹痛患者测量胰腺头部、体部和尾部的应变率比值,同时按照EUS慢性胰腺炎标准行Rosemont分类。在所有胰腺中,应变率比值在慢性胰腺炎病例中显著增高,在cut-off≥2.25,诊断CP准确率达91%。此外,在不同Rosemont分组之间应变比率比值显著不同。这项研究表明使用EUS弹性成像量化胰腺纤维化的严重程度成为可能,可以用于追踪慢性胰腺炎的进展。
Dominguez-Munoz等 [32] 应用应变率比值法研究了115例慢性胰腺炎患者,研究结果表明,其中35例胰腺外分泌功能不全患者组的应变率比值较高,应变率比值与胰腺外分泌功能不全可能性存在直接相关性,因此认为,EUS弹性成像可以通过评估慢性胰腺炎的纤维化程度从而为胰腺外分泌功能不全存在的可能性提供相关信息。
在Itokawa等 [33] 的研究中,炎性肿块的平均应变率比值为23.66±12.65,胰腺癌的平均应变率比值为39.08±20.54( P <0.05)。
(二)彩色直方图(hue histogram)
Sǎftoiu等 [6] 应用定量弹性成像中的彩色直方图法评价胰腺实质性肿块的良恶性。x轴中的色相直方图表示组织的弹性从0(最软)到255(最硬),y轴表示在ROI各弹性水平像素的数目。该研究表明,以175为cut-off值,敏感度、特异度、阳性预测值、阴性预测值、准确度分别为91.4%、87.9%、88.9%、90.6%、89.7%。之后的多中心研究表明 [29] ,对于211名胰腺癌患者和47例慢性胰腺炎患者应用彩色直方图方法评估,并使用同样的cut-off值(175),其敏感度、特异度、阳性预测值、阴性预测值、准确度分别为93.4%、66.0%、92.5%、68.9%、85.4%。
Sǎftoiu等 [7] 对EUS弹性成像应用计算机辅助的连续动态定量化分析法进行了欧洲多中心研究,结果认为对胰腺占位判断的准确度、灵敏度、特异度、阳性预测值和阴性预测值分别达85.4%、93.4%、66.0%、92.5%及68.9%。并应用定量EUS弹性成像彩色直方图法评估了54位患者的共计85个颈部、纵隔及腹腔淋巴结,最终78例淋巴结(良性37个,恶性41个)得到诊断 [16] 。恶性淋巴结的敏感度、特异度、准确度分别为85.4%、91.9%、88.5%,代表彩色直方图平均值(介于蓝色和绿色之间)的cut-off值为166。对应的AUC(曲线下面积)为0.928。
在郭瑾陶等 [34] 研究中,EUS检查过程中可疑恶性的病变,其中89.4%病例经由定性弹性成像检查提供了有用的证据,而97.8%病例经由定量弹性成像技术提供了有用的诊断依据。
Iglesias-Garcia等 [35] 比较了应变率比值法及彩色直方图法,认为在鉴别胰腺良恶性肿块的准确率中两种方法并未发现明显差异。
一项Meta分析 [36] ,包含了893例胰腺肿块的10篇研究,混合敏感性及特异性分别为0.98(95%CI 0.93~1.00)及0.69(95%CI 0.52~0.82)。EUS定性及定量弹性成像得到的结果相似,曲线下面积为0.94。另一项Meta分析 [37] 包括了1044位患者的13例研究。混合敏感性及特异性分别为0.95(95%CI 0.94~0.97)及0.67(95%CI 0.61~0.73),曲线下面积为0.9046。这些研究得出结论,弹性成像是区别胰腺肿块良恶性的可靠方法,可以与FNA互补,然而严重的慢性胰腺炎纤维化和胰腺恶性肿瘤之间难以鉴别 [36,37] 。
半定量及定量EUS弹性成像在一定程度上可以提高EUS对慢性胰腺炎的诊断,尤其是对早期或较轻的慢性胰腺炎。当然,半定量及定量弹性成像技术并不能替代EUS-FNA,但是它可以为病变的鉴别诊断提供一些额外的信息,从而为FNA结果提供一些支持证据,特别是针对那些FNA结果为阴性的良性病变。
三、操作方法及注意事项
首先应用B模式灰阶成像进行常规探查,了解病灶的部位、大小、形态及内部回声特征,然后根据探查结果确定拟行超声弹性成像的目标区域,ROI的选择要足够大,大于病变的一倍以上,应该包含至少50%的周围或者正常组织来进行对比 [38] 。
将超声影像切换至实时弹性成像模式,借助呼吸运动、胸、腹腔大动脉搏动及探头的压迫产生加压作用,从而获取目标部位的弹性成像图像并记录,以便分析。选取应变曲线位于波谷(释放相)时进行分析最为理想。
之前,也有一些研究讨论过一些因素对弹性成像结果的影响 [25] ,主要有探头对组织的压迫程度、呼吸道以及心脏运动产生的伪像、操作者的熟练程度等,大多数影响因素可以通过由经验丰富的操作者进行EUS操作所避免。为避免弹性成像误差,可以在每次弹性成像图像稳定5秒后再锁定界面,记录数值,每个病变多次测量,取其平均值作为最后结果。尽管这样的操作方法耗时较长,但是得出的数值客观性及可信性更高。
四、应用举例
EUS弹性成像目前主要应用于评估胰腺实性病变和肿大的淋巴结。
(一)胰腺疾病
EUS弹性成像在胰腺疾病中主要用于鉴别胰腺癌、慢性胰腺炎、胰腺内分泌肿瘤等。正常胰腺呈均质,以绿色为主。
1.胰腺癌
弹性成像呈蓝色与其他颜色相混杂,以蓝色为主(图10-2)。
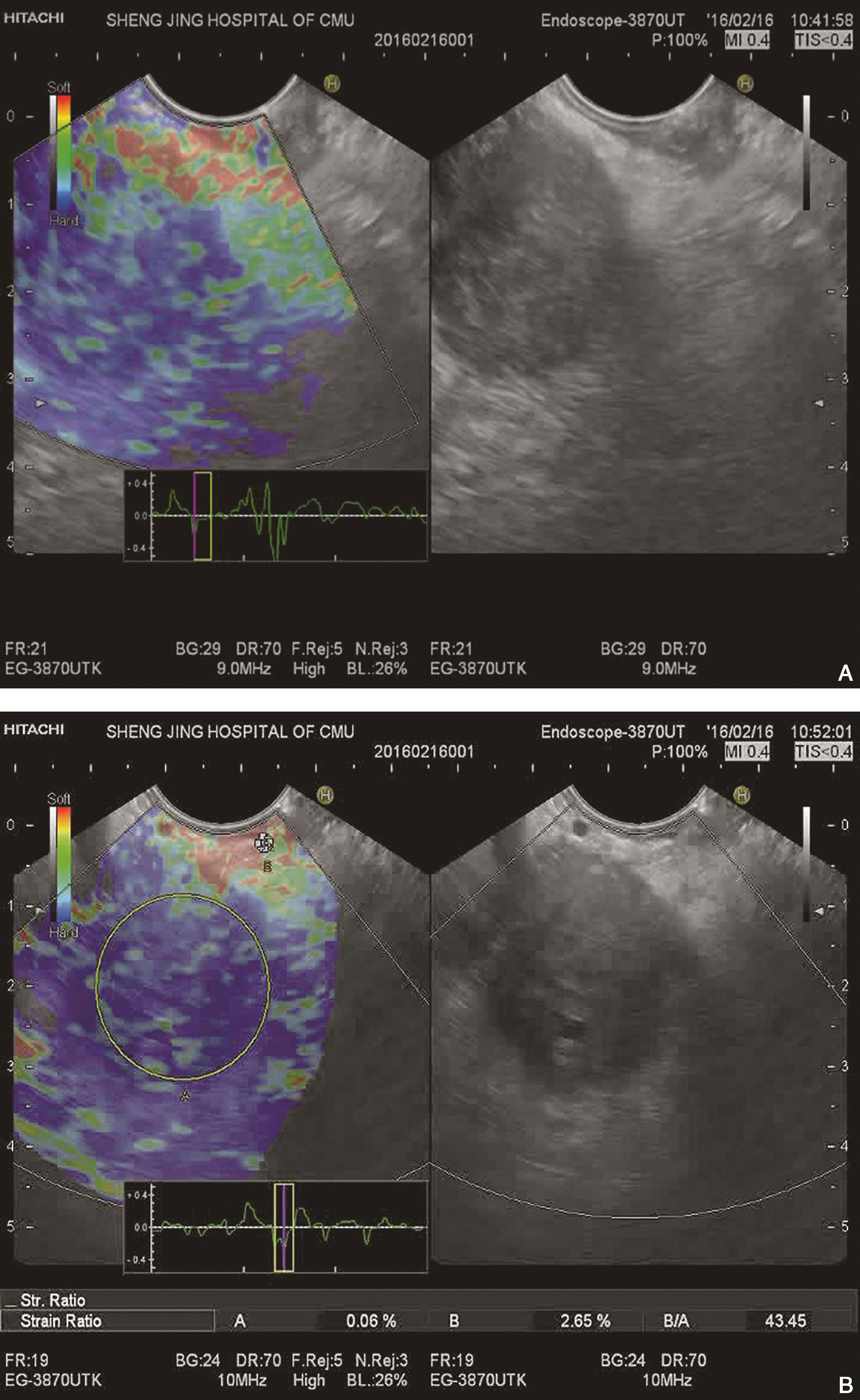
图10-2 胰腺癌
(A)EUS定性弹性成像显示该胰腺病变呈蓝色为主,质地硬。后经EUS-FNA取病理证实为胰腺癌;(B)EUS示胰头部一低回声肿块,内部回声不均,边缘模糊,超声切面大小约25mm×28mm。应用应变率比值法,病变区域内选择区域A,选取病变以外的显示为红色的较软组织为区域B,B/A为43.45。经EUS-FNA取病理证实为胰腺高分化腺癌
2.慢性胰腺炎
呈现不规则的不均质的绿色为主,伴有孤立的黄色、蓝色混合区域。
3.胰岛素瘤
好发于胰腺尾部、体部、头部,弹性成像以蓝色、绿色为主(图10-3)。
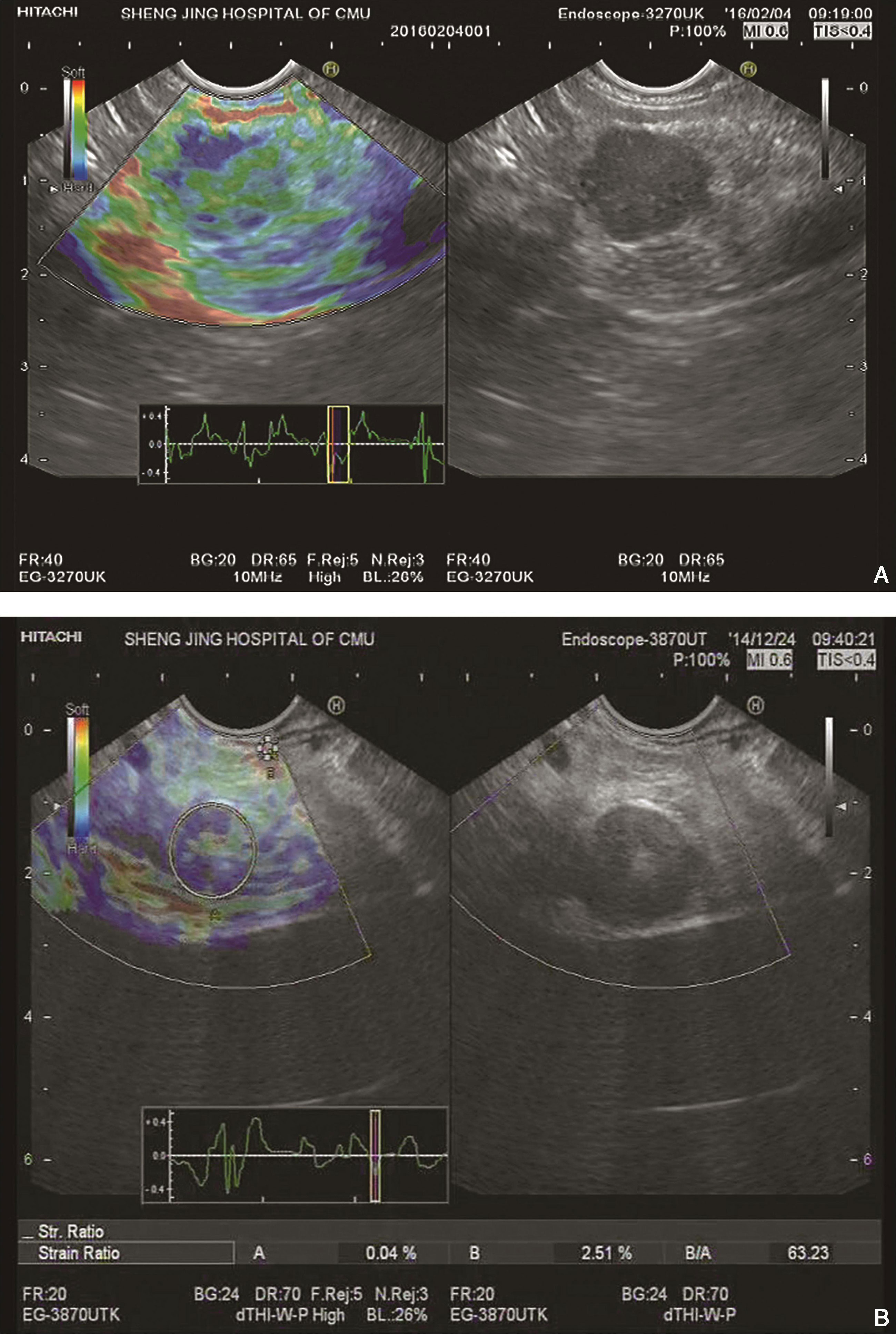
图10-3 胰岛素瘤
(A)胰腺体尾部类圆形低回声肿块,14mm×13mm,边界清晰,内部血流丰富,弹性成像以蓝色、绿色为主,提示质地偏硬;(B)EUS示胰腺体尾部一低回声肿块,内部回声不均,超声切面大小约20mm×16mm。应用应变率比值法,病变区域内选择区域A,选取病变以外的显示为红色的较软组织为区域B,B/A为63.23
(二)淋巴结
诊断恶性淋巴结的常规EUS标准有低回声结构、圆形、边界清晰、直径大于10mm,准确率约50%~100% [39] 。在应用FNA辅助时,准确率可大大提高。EUS弹性成像的应用可能在对靶向淋巴结进行FNA时发挥作用。一项包含7项研究总计431例淋巴结良恶性鉴别的Meta分析 [40] 表明,EUS弹性成像鉴别良恶性淋巴结的混合敏感性为88%,特异性为85%,ROC曲线下面积为0.9456。从而得出结论,EUS弹性成像是诊断恶性淋巴结的一种无创的、有广阔前景的技术,可能成为EUS-FNA有价值的辅助方法。
1.良性淋巴结
弹性成像呈黄色、绿色,质地较软(图10-4)。
2.恶性淋巴结
弹性成像以蓝色为主,与绿色混杂(图10-5)。
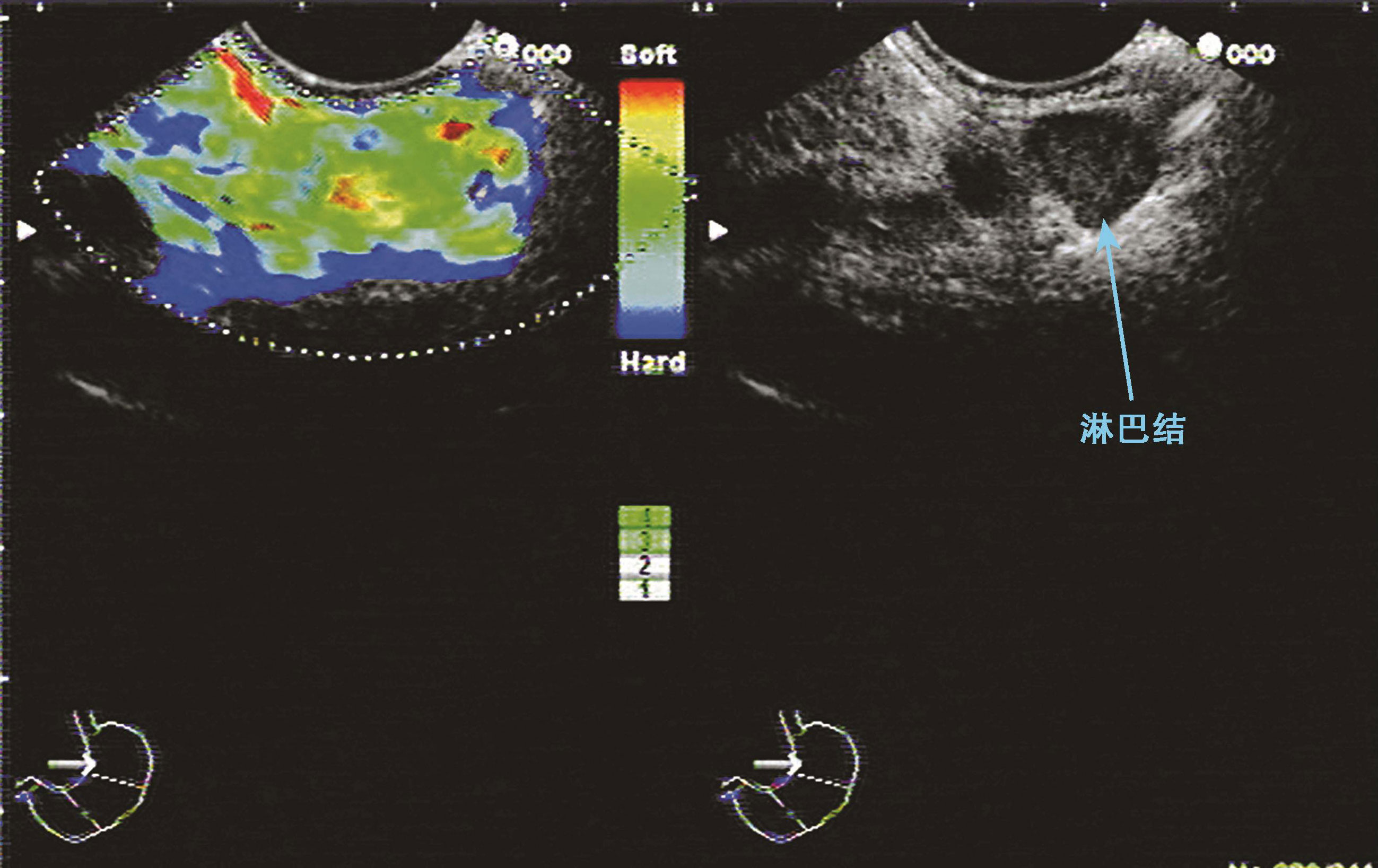
图10-4 良性淋巴结
EUS显示淋巴结为圆形,EUS定性弹性成像显示该淋巴结呈黄色、绿色,表示质地软。病理结果证明该淋巴结为良性
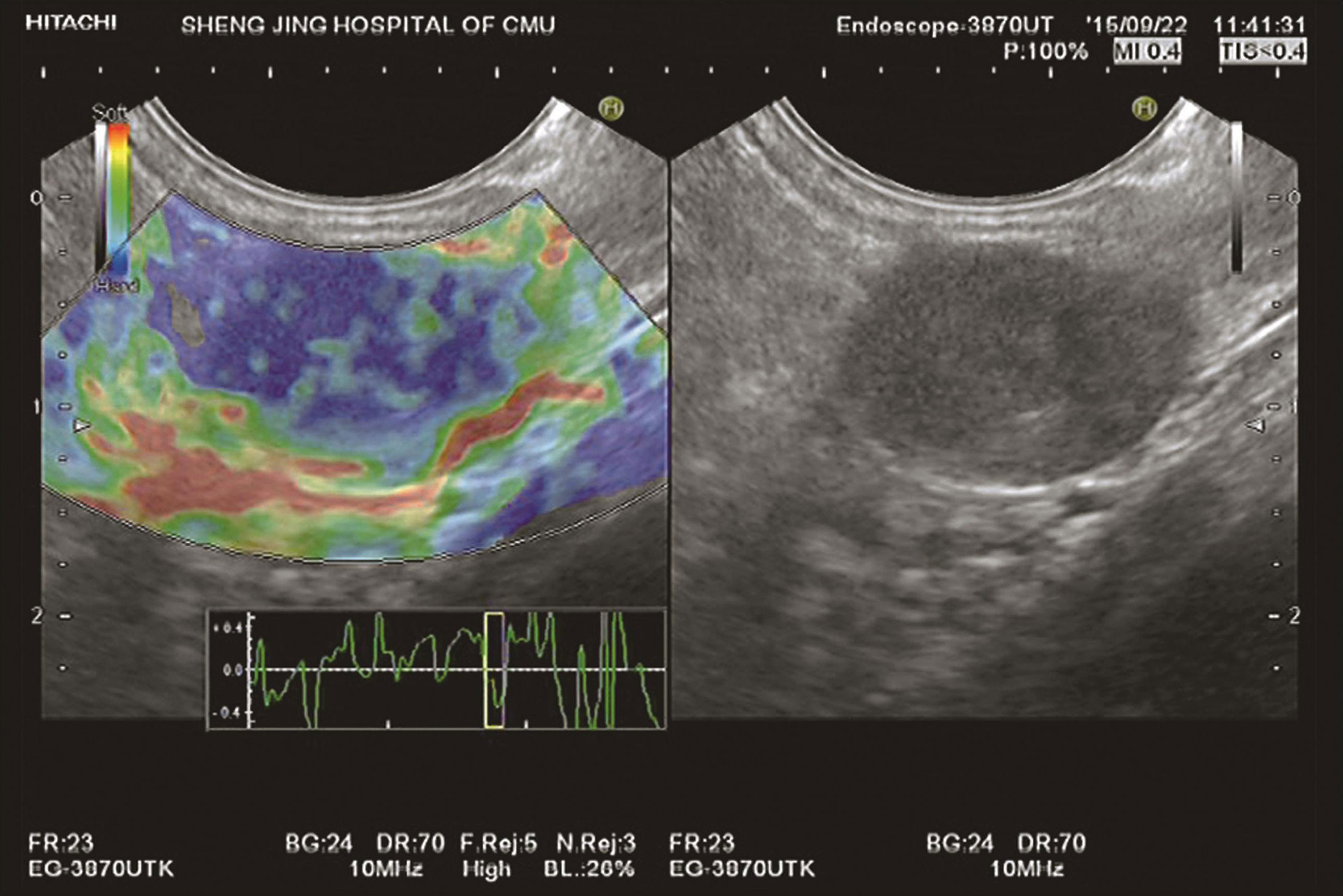
图10-5 恶性淋巴结
EUS定性弹性成像显示该淋巴结颜色呈蓝色与绿色混杂,以蓝色为主,质地硬。病理结果证明该淋巴结为恶性
(三)其他
1.经直肠EUS弹性成像
目前可以应用于前列腺癌、直肠癌、炎症性肠病等 [41-49] 。在前列腺癌方面,EUS弹性成像被认为优于单纯经直肠EUS检查的,且可以提高前列腺活检的特异性。
2.左肾上腺占位
由于左肾上腺邻近胃体后壁,常规EUS检查可以观察到 [50-53] 。研究表明,行左肾上腺的EUS-FNA准确率很高 [54] 。对于左肾上腺占位的EUS弹性成像仅仅在综述和病例报道中描述 [23] ,普遍认为,恶性病变通常较硬(呈蓝色),但是并没有提出弹性成像标准。
EUS弹性成像虽然在病变的良恶性判断中有着较高的准确性,但仅依据EUS及弹性成像影像学特征,往往无法对病变的具体性质做出判断,且主观性较强,其评估标准尚未达到统一。而对于一些无法行EUS-FNA或反复行EUS-FNA均为阴性的可疑病变,EUS弹性成像可提供具有重要价值的影像学依据。最新的欧洲指南建议 [55] ,弹性成像更适合成为FNA的诊断性辅助而非一线选择。国内外相继有大量文献报道了EUS弹性成像在胰腺占位病变及淋巴结良恶性鉴别中的应用,但对其他消化道占位病变诊断价值中的研究相对较少 [56] 。近来有一些EUS弹性成像应用的罕见病例报道,如诊断原发性输卵管癌 [57] 、诊断卵巢癌胃转移 [58] 等。相信在不久的未来,EUS弹性成像可能有更多适用范围,如区别实体肝脏占位的良恶性 [57-59] 、评估食管癌及胃癌的进展 [60,61] 、通过区分腺瘤或转移来评估左肾上腺实性病变等 [62] ,需要更进一步探索。
(刘文 孙思予)
参考文献
1.Diamantis A,Magiorkinis E,Koutselini H.Fine-needle aspiration(FNA)biopsy:historical aspects.Folia Histochem Cytobiol,2009,47:191-197.
2.Logroño R,Waxman I.Interactive role of the cytopathologist in EUS-FNA.Gastrointest Endosc,2001,54:485-490.
3.Anand V.Sahai.Endoscopic ultrasound-guided fine-needle aspiration:Getting to the point.Endosc Ultrasound,2014,3(1):1-2.
4.DeWitt J,LeBlanc J,McHenry L,et al.Endoscopic ultrasound guided fine needle aspiration of ascites.Clin Gastroenterol Hepatol,2007,5:609-615.
5.Wen L,Siyu S,Nan G,et al.Rupture of a duodenal stromal tumor during EUS-FNA:a case report.Endosc Ultrasound,2012,1(1):53-55.
6.Sǎftoiu A,Vilmann P,Gorunescu F,et al.Neural network analysis of dynamic sequences of EUS elastography used for the differential diagnosis of chronic pancreatitis and pancreatic cancer.Gastrointest Endosc,2008,68(6):1086-1094.
7.Sǎftoiu A,Iordache SA,Gheonea DI,et al.Combined contrast-enhanced power doppler and real-time sonoelastography performed during EUS,used in the differential diagnosis of focal pancreatic masses.Gastrointest Endosc,2010,72(4):739-747.
8.Dietrich CF,Săftoiu A,Jenssen C.Real time elastography endoscopic ultrasound(RTE-EUS),a comprehensive review.Eur J Radiol,2014,83(3):405-414.
9.Popescu A,Sǎftoiu A.Can elastography replace fine needle aspiration?Endosc Ultrasound,2014,3(2):109-117.
10.Teoh A.Y,Tang R.S.Clinical evaluation of new diagnostic modalities of endoscopic ultrasound for pancreaticobiliary diseases.Dig Endosc,2015,27(Suppl.1):55-59.
11.Shiina T,Nitta N,Ueno E,et al.Real time tissue elasticity imaging using the combined autocorrelationmethod.Jpn JMed Ultrasonics,2002,29:119-128.
12.Frey H.Realtime elastography.A new ultrasound procedure for the reconstruction of tissue elasticity.Radiologe,2003,43:850-855.
13.Konofagou EE.Quo vadis elasticity imaging?Ultrasonics,2004,42:331-336.
14.Itoh A,Ueno E,Tohno E,et al.Breast disease:Clinical application of US elastography for diagnosis.Radiology,2006,239:341-350.
15.Talwalkar JA,Kurtz DM,Schoenleber SJ,etal.Ultrasound-based transientelastography for the detectionof hepatic fibrosis:systematic review and meta-analysis.Clin Gastroenterol Hepatol,2007,5(10):1214-1220.
16.Sǎftoiu A,Vilmann P,Ciurea T et al.Dynamic analysis of EUS used for the differentiation of benign and malignant lymph nodes.Gastrointest Endosc,2007,66(2):291-300.
17.Nadan R,Irena H,Milorad O,etal.EUSelastography in the diagnosis of focal liver lesions.Gastrointest Endosc,2007,66:823-824.
18.Janssen J,Schlörer E,Greiner L.EUS elastography of the pancreas:fessibiliy and pattern description of the normal pancreas,chronic pancreatitis,and focal pancreatic lesions.Gastrointest Endosc,2007,65(7):971-978.
19.Janssen J,Dietrich CF,Will U,et al.Endosonographic elastography in the diagnosis of mediastinal lymph nodes.Endoscopy,2007,39:952-957.
20.Iglesias-Garcia J,Larino-Noia J,Abdulkader I,et al.EUS elastography for the characterization of solid pancreaticmasses.Gastrointest Endosc,2009,70(6):1101-1108.
21.Mayerle J,Simon P,Dickson EJ,et al.The role of EUS guided elastography to diagnose solid pancreatic mass lesions.Pancreas,2010,39:1334.
22.Hirooka Y,Itoh A,Kawashima H,et al.Clinical oncology for pancreatic and biliary cancers:Advances and current limitations.World JClin Oncol,2011,2:217-224.
23.Sǎftoiu A,Vilman P.Endoscopic ultrasound elastography-a new imaging technique for the visualization of tissue elasticity distribution.JGastrointestin Liver Dis,2006,15(2):161-165.
24.Giovannini M,Hookey LC,et al.Endoscopic ultrasound elastography:the first step towards virtual biopsy?Preliminary results in 49 patients.Endoscopy,2006,38(4):344-348.
25.GiovanniniM,Thomas B,Erwan B,et al.Endoscopic ultrasound elastography for evaluation of lymph nodes and pancreaticmasses:a multicenter study.World J Gastroenterol,2009,15(13):1587-1593.
26.孙思予,刘香,葛楠,等.内镜超声弹性成像对消化道肿瘤淋巴结转移的诊断价值初探.中华消化内镜杂志,2008,25:131-133.
27.Lariño-Noia J,Iglesias-García J,Álvarez-Castro A,et al.Usefulness of endoscopic ultrasound(EUS)elastography for the detection of malignant infiltration of mediastinal and abdominal lymph nodes.Gastroenterology,2009,5:A-44.
28.Sǎftoiu A,Vilmann P,Gorunescu F,et al.Accuracy of endoscopic ultrasound elastography used for differential diagnosis of focal pancreatic masses:amulticenter study.Endoscopy,2011,43:596-603.
29.Iglesias-Garcia J,Lariño-Noia J,Abdulkader I,et al.Quantitative endoscopic ultrasound elastography:an accurate method for the differentiation of solid pancreatic masses.Gastroenterology,2010,139:1172-1180.
30.Iglesias-Garcia J,Lariño-Noia J,Dominguez-Muñoz JE.Elastography in the evaluation of chronic pancreatitis.Gastroenterol Hepatol,2011,34:629-634.
31.Iglesias-Garcia J,Domínguez-Muñoz JE,Castiñeira-Alvariño M,et al.Quantitative elastography associated with endoscopic ultrasound for the diagnosis of chronic pancreatitis.Endoscopy,2013,45:781-788.
32.Dominguez-Muñoz JE,Iglesias-Garcia J,Castineira Alvarino M,et al.EUS elastography to predict pancreatic exocrine insufficiency in patientswith chronic pancreatitis.Gastrointest Endosc,2015,81(1):136-142.
33.Itokawa F,Itoi T,Sofuni A,et al.EUS elastography combined with the strain ratio of tissue elasticity for diagnosis of solid pancreatic masses.JGastroenterol,2011,46:843-853.
34.郭瑾陶,孙思予,葛楠,等.内镜超声定量弹性成像技术对胰腺良恶性病变鉴别诊断价值研究.中国实用内科杂志,2013,33(10):808-811.
35.Iglesias-Garcia J,Lindkvist B,Lariño-Noia J,et al.Endoscopic ultrasound elastography.Endoscopic Ultrasound,2012,1(1):8-16.
36.Ying L,Lin X,Xie ZL,et al.Clinical utility of endoscopic ultrasound elastography for identification of malignant pancreatic masses:A meta-analysis.J.Gastroenterol Hepatol,2013,28:1434-1443.
37.MeiM,Ni J,Liu D,et al.EUS elastography for diagnosis of solid pancreatic masses:A meta-analysis.Gastrointest Endosc,2013,77:578-589.
38.Hirche TO,Ignee A,Barreiros AP,etal.Indications and limitations of endoscopic ultrasound elastography for evaluation of focal pancreatic lesions.Endoscopy,2008,40:910-917.
39.Janssen J.(E)US elastography:Current status and perspectives.Z.Gastroenterol,2008,46:572-579.
40.Xu W,Shi J,Zeng X,et al.EUSelastography for the differentiation of benign and malignant lymph nodes:a meta-analysis.Gastrointest Endosc,2011,74:1001-1009.
41.Gersak M.M,Badea R,Graur F,et al.Endoscopic ultrasound for the characterization and staging of rectal cancer.Current state of themethod.Technological advances and perspectives.Med Ultrason,17(2):227-234.
42.Badea R,Gersak MM,Dudea SM,et al.Characterization and staging of rectal tumors:endoscopic ultrasound versus MRI/CT.Med Ultrason,2015,17(2):241-247.
43.Kamoi K,Okihara K,Ochiai A,et al.The utility of transrectal real-time elastography in the diagnosis of prostate cancer.Ultrasound Med Biol,2008,34:1025-1032.
44.Kapoor A,Mahajan G,Sidhu BS.Real-time elastography in the detection of prostate cancer in patients with raised psa level.Ultrasound Med Biol,2011,37:1374-1381.
45.Miyagawa T,Tsutsumi M,Matsumura T,et al.Real-time elastography for the diagnosis of prostate cancer:evaluation of elastographic moving images.Jpn JClin Oncol,2009,39:394-398.
46.Giurgiu CR,Manea C,Crisan N,et al.Real-time sonoelastography in the diagnosis of prostate cancer.Med Ultrason,2011,13:5-9.
47.Waage JE,Havre RF,Odegaard S,et al.Endorectal elastography in the evaluation of rectal tumours.Colorectal Dis,2011,13:1130-1137.
48.Rustemovic N,Cukovic-Cavka S,Brinar M,et al.A pilot study of transrectal endoscopic ultrasound elastography in inflammatory bowel disease.BMCGastroenterol,2011,11:113.
49.Allgayer H,Ignee A,Dietrich CF.Endosonographic elastography of the anal sphincter in patients with fecal incontinence.Scand J Gastroenterol,2010,45:30-38.
50.Chang KJ,Erickson RA,Nguyen P.Endoscopic ultrasound(EUS)and EUS-guided fine-needle aspiration of the left adrenal gland.Gastrointestinal endoscopy,1996,44(5):568-572.
51.Dietrich CF,Wehrmann T,Hoffmann C,etal.Detection of the adrenal glands by endoscopic or transabdominal ultrasound.Endoscopy,1997,29:859-864.
52.EloubeidiMA,Beydoun M,Jurdi N,et al.Transduodenal EUS-guided FNA of the right adrenal gland to diagnose lung cancer where percutaneous approach was not possible.JMed Liban,2011,59:173-175.
53.Jenssen C,Dietrich CF.Ultrasound and endoscopic ultrasound of the adrenal glands.Ultraschall Med,2010,31:228-247.
54.Uemura S,Yasuda I,Kato T,et al.Preoperative routine evaluation of bilateral adrenal glands by endoscopic ultrasound and fine needle aspiration in patients with potentially resectable lung cancer.Endoscopy,2013,45:195-201.
55.Cosgrove D,Piscaglia F,Bamber J,et al.EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography.Part 2:Clinical applications.Ultraschall Med,2013,34:238-253.
56.Dawwas MF,Taha H,Leeds JS,et al.Diagnostic accuracy of quantitative EUS elastography for discriminating malignant from benign solid pancreatic masses:a prospective,single-center study.Gastrointest Endosc,2012,76(5):953-961.
57.Kim EB,Lee TH,Kim JS,et al.Primary fallopian tube carcinoma diagnosed with endoscopic ultrasound elastography with fine needle biopsy.Clin Endosc,47(5):464-468.
58.Dietrich CF.Real-time tissue elastography.Multiple clinical applications.Multiple clinical solutions.Endoskopie Heute,2011,24:177-212.
59.Carrara S,Doglioni C,Arcidiacono PG,et al.Gastric metastasis from ovarian carcinoma diagnosed by EUS-FNA biopsy and elastography.Gastrointest Endosc,2011,74:223-225.
60.Rustemovic N,Hrstic I,Opacic M,et al.EUSelastography in the diagnosis of focal liver lesions.Gastrointest Endosc,2007,66:823-824.
61.Iglesias-Garcia J,Lariñ-Noia J,Souto R,et al.Endoscopic ultrasound(EUS)elastography of the liver.Rev Esp Enferm Dig,2009,101:717-719.
62.Paterson S,Duthie F,Stanley AJ.Endoscopic ultrasound-guided elastography in the nodal staging of oesophageal cancer.World J Gastroenterol,2012,18:889-895.