第十一章
|
|
|
|
造影增强内镜超声
造影增强内镜超声(contrast-enhanced endoscopic ultrasound,CE-EUS) [1] 是一种EUS下,应用超声造影剂得到体内组织高分辨率超声图像的方法。这项技术有两种不同的亚型:不需要特殊软件的有着高机械指数(mechanical index,MI)的造影增强多普勒内镜超声(contrast-enhanced Doppler endoscopic ultrasound,CDEUS) [2-6] ;使用特殊对比模式的低机械指数的谐波造影增强内镜超声(contrast-enhanced harmonic endoscopic ultrasound,CH-EUS) [1,7] 。采用超声造影技术可以增强显示血管内彩色血流信号,提高对低速血流的微小血管的检出敏感性,从而有利于肿瘤新生血管的显示,有助于判断肿块的良、恶性 [2,3] ,目前多应用于胰腺实性肿瘤(胰腺癌、胰腺内分泌肿瘤等)、胰腺囊性肿瘤(黏液囊腺瘤、导管内乳头状黏液瘤等)、胰腺假性囊肿、胰腺炎、肝外胆管癌 [4-6] ,也可以应用于胃肠间质瘤、平滑肌瘤的鉴别 [7] ,以及肾上腺肿瘤 [8,9] 、良恶性淋巴结的鉴别 [10] 。正常组织及病变组织之间可显示不同的增强模式、时相特点及增强强度分级。日本的多项研究 [11-13] 显示,CE-EUS对于小于2cm的胰腺肿块的诊断价值优于多层螺旋CT,CE-EUS联合EUS-FNA可显著提高EUS-FNA的诊断价值。但是有些恶性病变组织学生长方式可能类似良性病变,因此该项技术的实用性尚需进一步研究及评估。
一、超声造影剂(ultrasound contrast agents,UCAs)
超声造影剂是一类能显著增强超声背向散射强度的化学制剂,其主要成分是微气泡,一般直径为2~10μm,可以通过肺循环。与CT或MRI造影剂不同的是,UCAs存在于血管内,并不弥散进间质内,对肝肾功能没有损害,不含碘成分,无放射性危害,使用安全。但对造影剂过敏者、急性心肌梗死、急性冠脉综合征、不稳定型心肌缺血、呼吸功能障碍、肺功能不全患者禁用,且不宜应用于孕妇及哺乳期妇女、未成年人、活动性结核等患者。
1.超声造影成像原理
造影剂微气泡在超声的作用下会发生振动,可以产生高回声,散射强超声信号。由于微小气泡的大小与红细胞相近,这就使其在静脉注射后限制在血管系统内,从而在图像上更清晰地显示血管位置和大小,有效地显示血液组织灌注情况。气泡散射还有一个十分有意义的特性——气泡共振。当入射声波的频率与气泡共振频率一致时,入射声波的能量全部被气泡共振吸收,形成共振散射,散射截面更大。
2.造影剂的分代
造影剂的分代主要是依据微泡内包裹气体的种类来划分的。第一代造影剂微泡内含空气,包膜一般为白蛋白或半乳糖等聚合体,具有包膜较厚、弹性差、包裹的空气较易溶于水等特点,决定了它持续时间短、容易破裂,从而限制了临床应用中观察和诊断的时间,适合高机械指数成像,MI在0.5以上才有良好显像效果。第一代造影剂包括Albunex(S-132)、Levovist(SHU-508A)等。
目前第二代超声造影剂为采用变性的白蛋白、脂质体、多聚体以及各种表面活性剂等材料包裹的高密度惰性气体的微泡造影剂,外膜薄而柔软,直径一般在2~5μm左右,不易溶于水或血液,稳定时间长,振动及回波特性好。第二代UCAs较第一代包含更低水溶性及弥散系数的惰性气体,从而提高了稳定性及造影持续时间,适合低机械指数造影,MI在0.05即可,超过0.4即破裂。第二代造影剂包括SonoVue(Bracco Imaging,Milan,Italy)、Sonazoid(Daiichi-Sankyo,Tokyo,Japan;GE Health care Milwaukee,WI,USA)、Definity(Lantheus Medical Imaging,North Billerica MA,USA)、Optison等。
二、操作方法
我们以注射超声造影剂声诺维(SonoVue)为例。
1.先行常规EUS检查,观察病变的部位、大小、边界、回声,找到目标病灶或区域后,调整超声功率至低机械指数。
2.向小瓶内注入生理盐水5ml,用力振荡瓶子20秒,直至冻干粉末(25mg)完全分散,配成5g/L浓度的均一的白色乳状液体。将微泡混悬液抽取至注射器后在较短的时间内快速注入外周静脉(一般选择肘部浅静脉,单次剂量约2.4ml),随之应用生理盐水5ml快速推入冲管。混悬液配制后6小时内可随时将所需容量抽取到注射器中使用。抽取前,振摇小瓶使微泡重新均匀分散后抽取至注射器中备用注射。
3.自注射超声造影剂后开始计时,嘱咐患者平稳呼吸,连续动态观察靶组织的不同时相的造影剂情况,造影过程中保持各参数不变,直至增强效应基本消失,获取3~5分钟动态图像,并保存,以备结果分析。
4由于超声造影剂安全性较高,且患者对超声造影剂有比较好的耐受性,在造影过程中可根据需求重复给药,但一般至少应间隔5分钟以上。
三、造影增强内镜超声应用举例
相关术语 [14] :
高增强:病灶的超声造影显示强度高于其所在区域作为参照的靶组织或靶器官的显示强度。
等增强:病灶的超声造影显示强度等于其所在区域作为参照的靶组织或靶器官的显示强度。
低增强:病灶的超声造影显示强度低于其所在区域作为参照的靶组织或靶器官的显示强度。
充盈缺损:超声造影剂未能进入到病灶区域并与病灶所在组织作为参照增强相比较而呈现的病灶未显现的现象。
造影增强出现时间:从注射造影剂至特定靶目标开始出现增强的时间。
造影达到峰值时间:从注射造影剂至特定靶目标增强达到最高峰的时间。
开始廓清时间:从注射造影剂至特定靶目标增强达到最高峰后开始消退的时间。
完全廓清时间:从注射造影剂至特定靶目标增强后至增强完全消退的时间。
(一)胰腺疾病
胰腺超声造影分期:胰腺的血供完全来自于动脉血供,因此胰腺实质开始增强的时间与主动脉增强时间几乎一致。正常的胰腺在注入造影剂后20秒左右开始增强,50秒左右达到峰值,为短暂或瞬间均匀的增强状态,之后开始快速廓清,在60秒左右与周围组织或肝脏相比,呈明显的低增强改变。胰腺实性及囊性病变的鉴别诊断和体表超声方法的描述类似 [15-19] ,主要应用于鉴别肿块形成的慢性胰腺炎及慢性胰腺炎患者的导管腺癌。
1.胰腺癌
胰腺导管腺癌是最常见的胰腺原发性恶性肿瘤,由于内部乏血管,约90%病例在所有阶段都呈典型的低增强 [20,21] ,约10%呈等增强。超声造影表现为病灶增强晚于周围组织或与周围组织同步,呈不均匀低增强,无显著达峰表现,消退明显早于周围组织,肿瘤内可见不规则分布的扭曲微血管缓慢由周边向中央灌注(图11-1)。
2.胰岛素瘤
由于其内部丰富的动脉血管结构,多数胰岛素瘤表现为增强早于胰腺实质,病灶呈整体、均匀的高增强,边界清晰,廓清时间晚于胰腺实质,造影剂呈现早进晚出的表现(图11-2)。
3.胰腺囊性病变
(1)胰腺假性囊肿囊壁较厚并常有囊内纤维间隔,表现为内部囊性结构、囊壁和间隔均无明显增强,外壁强化明显。
(2)囊腺瘤内部实质部分与周围胰腺组织同时均匀增强,内部均见囊性无增强区,囊壁和囊内间隔增强(图11-3)。但是对于大的囊性病变,中心有坏死区,导致病变表现为不均匀,给诊断增加了难度。
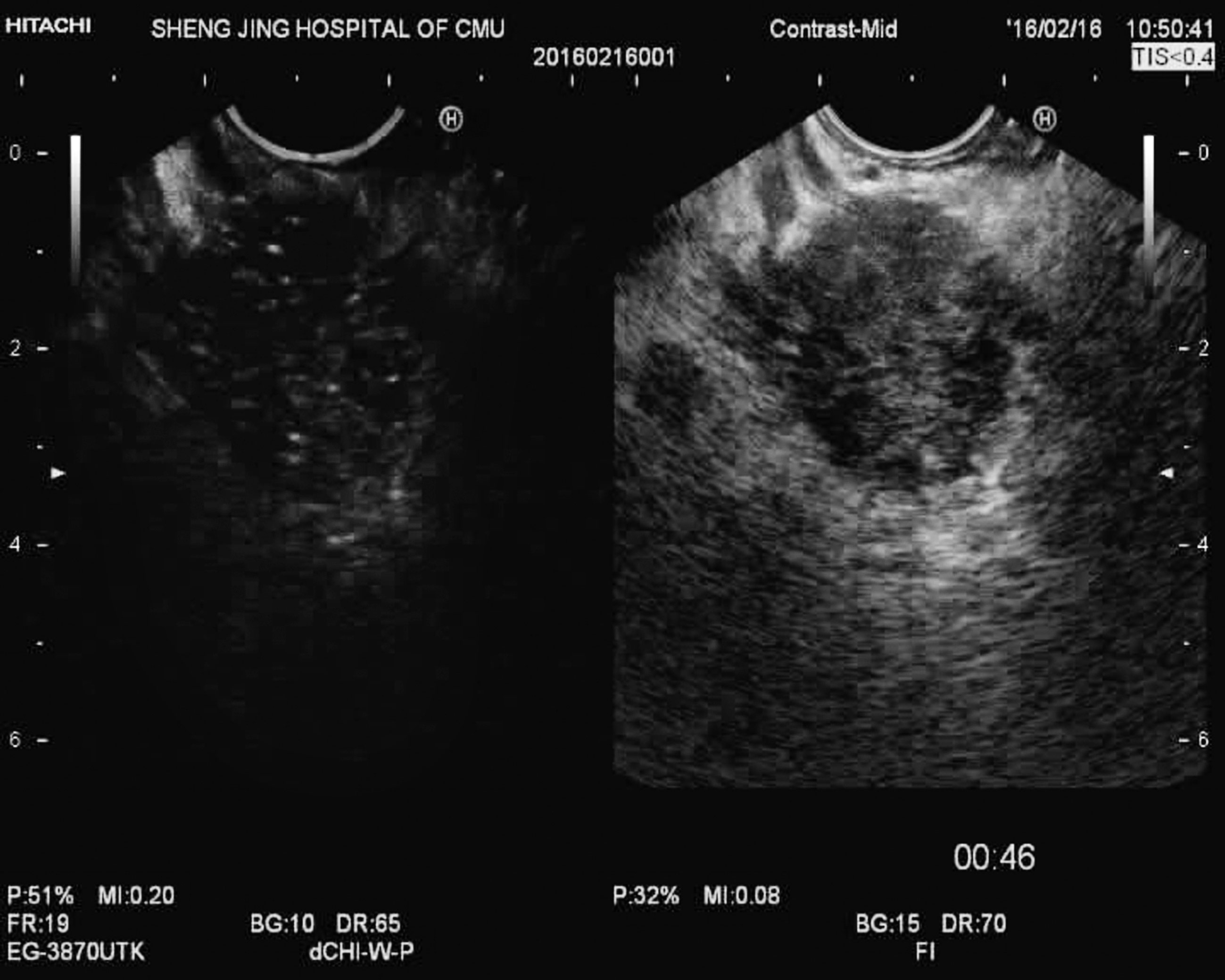
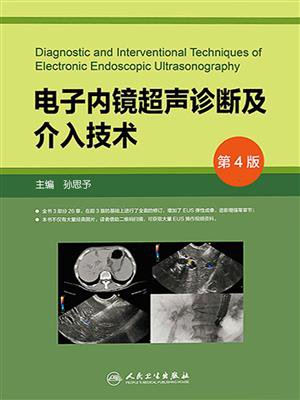
图11-1 胰腺癌
EUS示胰头部一低回声肿块,内部回声不均,形状不规则,边缘模糊,超声切面大小约25mm×27mm。超声造影示病灶增强晚于周围组织,呈不均匀低增强,无显著达峰表现,消退明显早于周围组织。行EUS-FNA,穿刺病理诊断为胰腺高分化腺癌
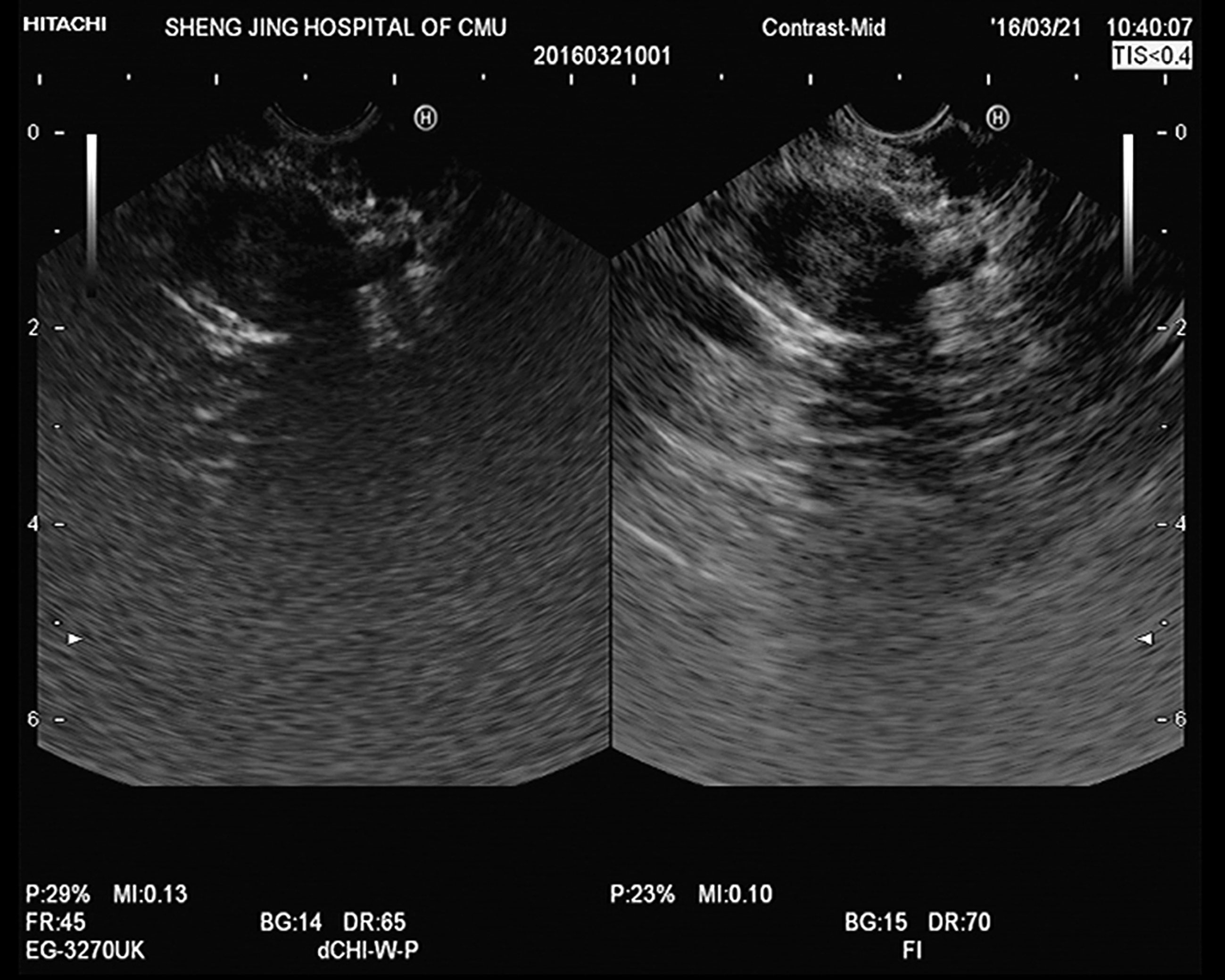
图11-2 胰岛素瘤
胰腺体尾部一类圆形低回声肿块,17mm×13mm,内部血流丰富,边界清晰,增强早于胰腺实质,呈整体、均匀的高增强,廓清时间晚于胰腺实质
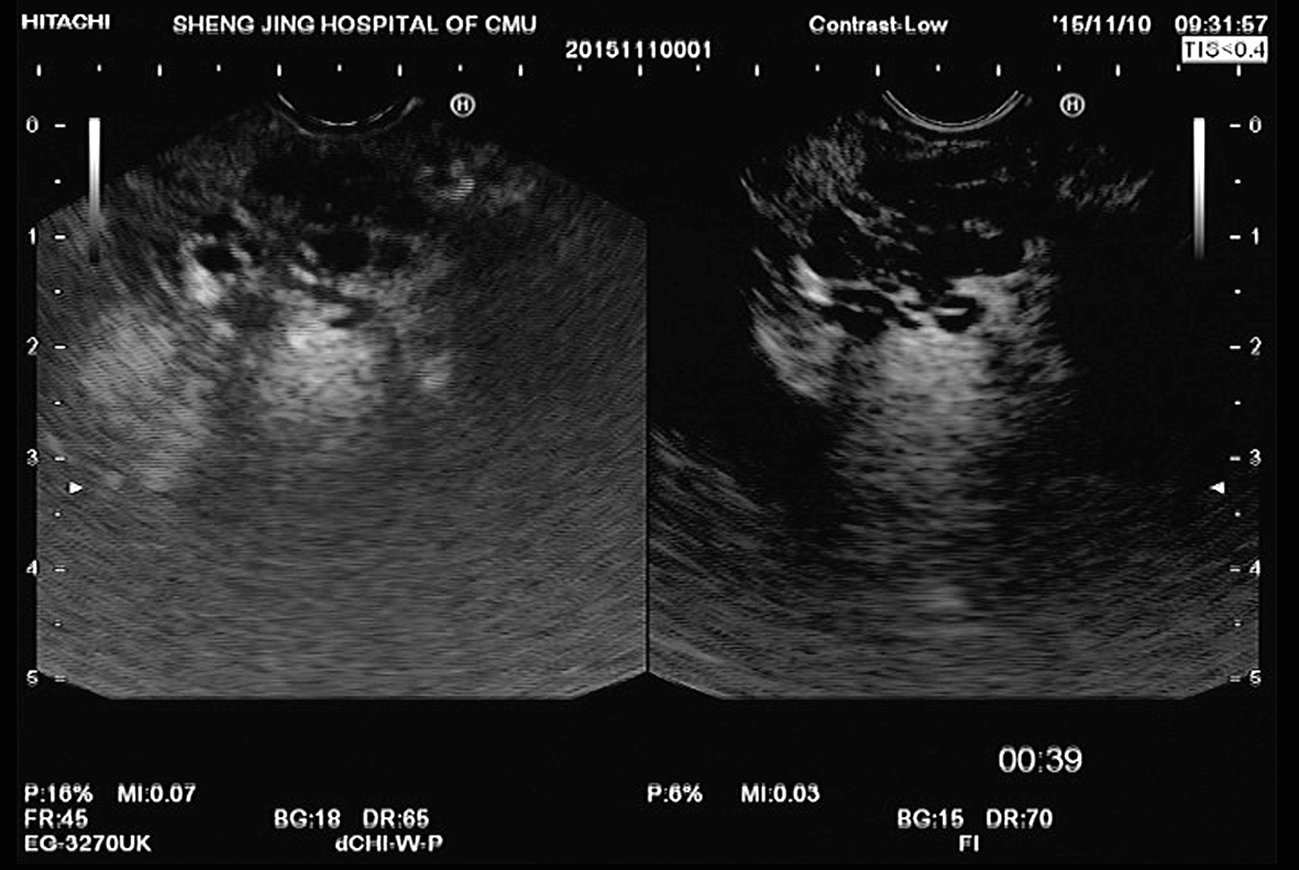
图11-3 胰腺囊性病变
EUS示胰头部一囊实性包块,超声切面大小约20mm×19mm。超声造影示内部实质部分与周围胰腺组织同时均匀增强,内部见囊性无增强区,囊壁和囊内间隔增强。行EUS-FNA,穿刺病理诊断黏液性囊性肿瘤
4.胰腺炎
(1)胰腺炎症肿块的增强及廓清与周围组织基本同步,达峰显著,充盈均匀。
(2)慢性局灶性胰腺炎:增强时间、增强速度和增强水平与周围正常胰腺组织基本一致,注射造影剂后,原本EUS下清晰显示的低回声病灶反而显示不清;当内部有坏死时可见低或无增强区(图11-4)。
(3)局灶和弥漫性的自身免疫性胰腺炎典型表现是均匀的高增强(图11-5)。
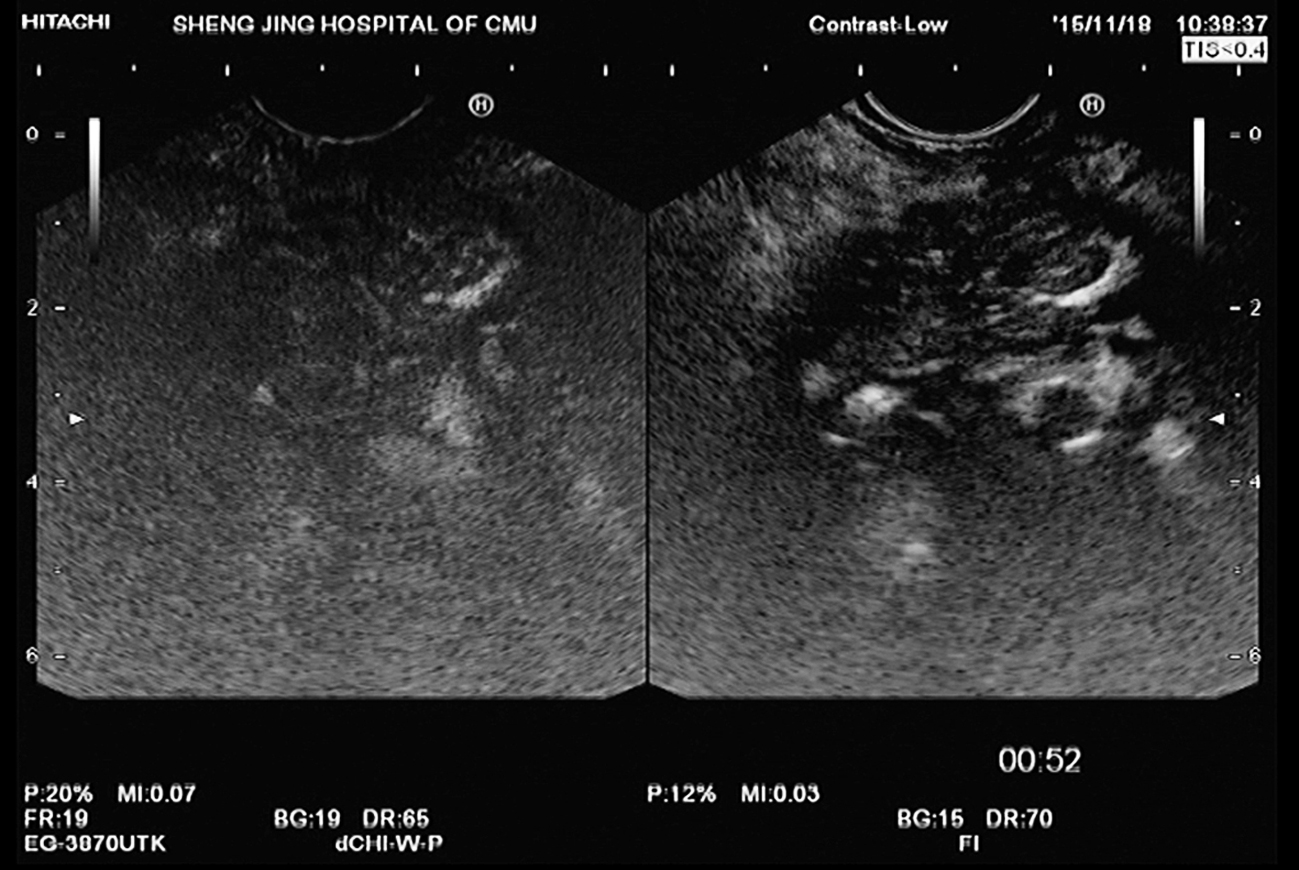
图11-4 慢性胰腺炎
EUS提示胰腺尾部萎缩,胰腺头部饱满,回声减低,主胰管扩张,直径最宽约8mm,扩张胰管及胰腺实质内见多发高回声光团,后方伴声影。超声造影可见增强时间、增强速度和增强水平与周围正常胰腺组织基本一致
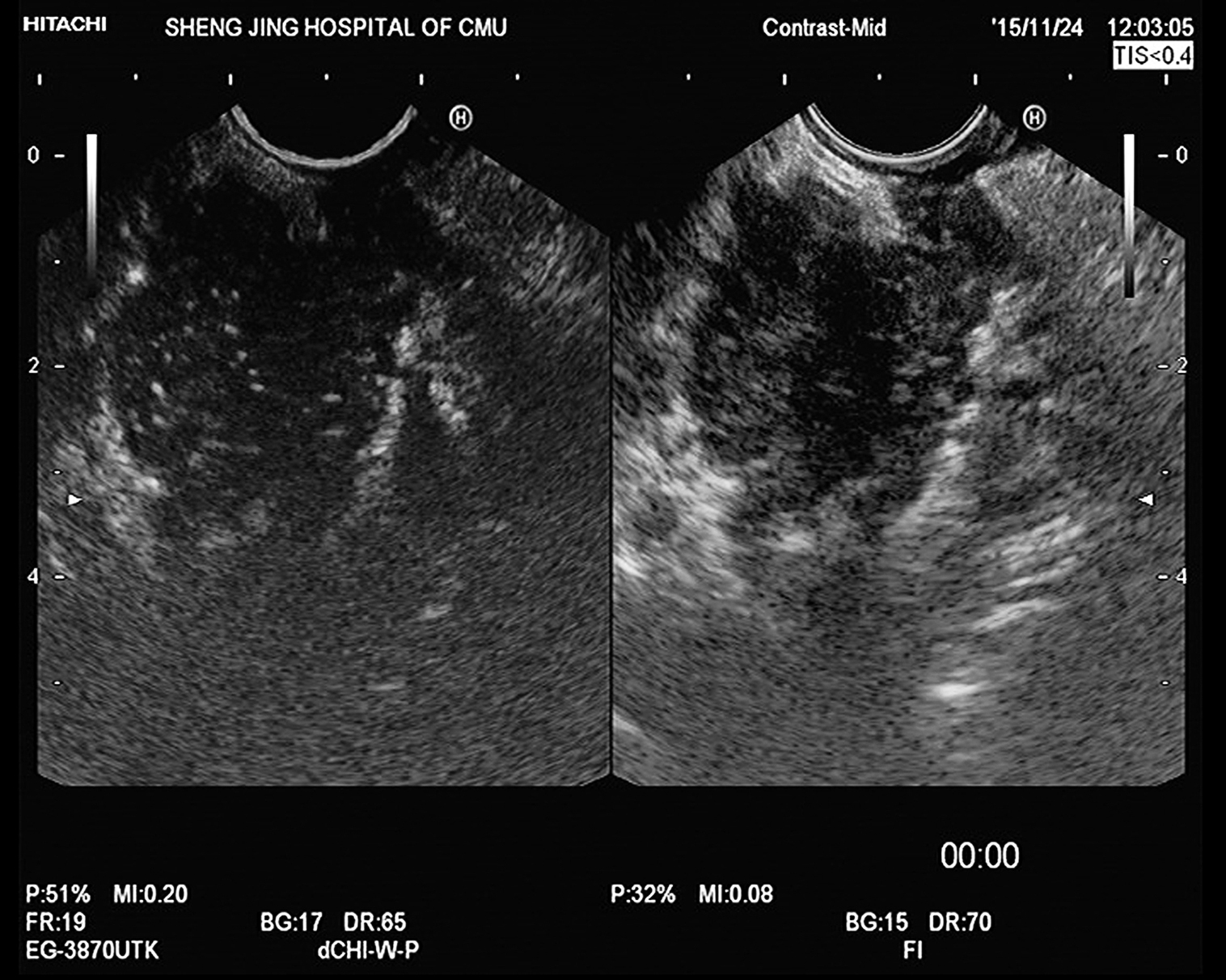
图11-5 自身免疫性胰腺炎
EUS示全胰腺形态饱满,回声减低,胰管未见扩张,超声造影见均匀的高增强
(二)淋巴结
1.良性淋巴结
(1)三角形的低回声结节,边界清晰。
(2)注射造影剂后立即出现淋巴结内富血管结构,呈弥漫、均匀性增强。
(3)多普勒频谱分析,符合静脉血流特点。
2.恶性淋巴结
(1)边界清晰的低回声、近圆形结节。
(2)注射造影剂后,可见肿瘤内少量微血管结构,呈明显的非均匀性增强,内部可见灶状低增强或充盈缺损区。
(3)多普勒频谱分析,符合动脉血流特点。
(三)黏膜下肿瘤
胃肠间质瘤呈典型的动脉期高增强,有时内部可见坏死(图11-6);平滑肌瘤显示为动脉期低增强;脂肪瘤通常很少增强。但目前超声造影应用于上皮下病变并不是欧洲超声生物学与医学委员会指南的一部分 [22-25] 。
随着EUS技术的不断进步及超声造影剂的发展,CE-EUS已被应用于很多疾病,包括胰腺、淋巴结、胃肠道黏膜下肿瘤、胆囊、炎症性肠病、消化道肿瘤的浸润及分期等。Choi等 [26] 认为对直径>10mm的胆囊息肉患者,CE-EUS明显优于普通的EUS检查。国外还有研究应用超声造影联合TIC(time intensity curve,时间强度曲线)分析软件评估溃疡性结肠炎及克罗恩病病变组织的浸润范围及病变活动性的报道 [27,28] 。此外,CEEUS可使用造影剂显示肿瘤新生血管,有助于评估和监测抗血管生成药物的疗效,并且可以通过量化肿瘤灌注进行分子成像 [29] 。由于其增强能力,CE-EUS检测相对乏血管的胰腺导管腺癌比常规EUS更敏感、更准确 [30-32] ,而且在评估胰腺肿瘤的术前T分期方面,CE-EUS的准确度也高于常规EUS [33] 。CE-EUS亦可在一定程度上弥补常规EUS对小病灶检查的不足 [31] 。
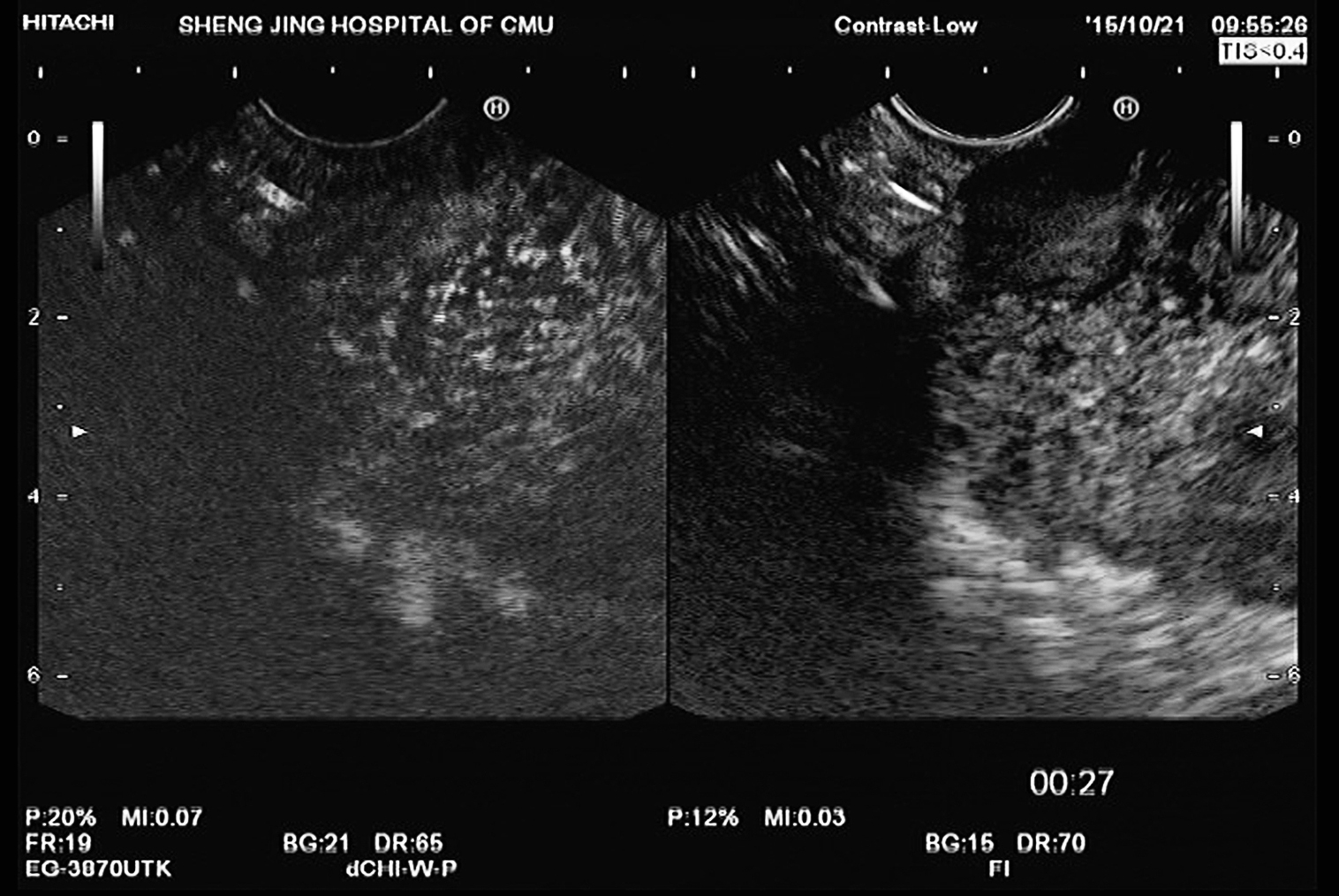
图11-6 十二指肠间质瘤
EUS示十二指肠肠壁超声第四层结构内一低回声肿块,内部回声不均,形状不规则,呈外生型,突向腹腔,边界尚清楚,超声切面大小约90mm×60mm,超声造影显示动脉期高增强。行EUS-FNA,穿刺病理诊断为十二指肠间质瘤
尽管CE-EUS技术在逐步提高,增强图像的分析仍具有一定主观性。为了提高客观性,入流时间映射(inflow timemapping)已经被提出作为一种新的工具进行客观定量评价 [34] 。具有3D模式的CE-EUS也可以在一定程度上减少操作者的主观影响 [35,36] 。然而这些新的技术的临床应用目前仅限于病例报告和少数的研究,还需要进一步的大样本研究。
(刘文 孙思予)
参考文献
1.Dietrich CF,Ignee A,Frey H.Contrast-enhanced endoscopic ultrasound with low mechanical index:a new technique.Z Gastroenterol,2005,43:1219-1223.
2.BhutaniMS,Hoffman BJ,van Velse A,et al.Contrast-enhanced endoscopic ultrasonography with galactosemicroparticles:SHU508 A(Levovist).Endoscopy,1997,29:635-639.
3.Becker D,Strobel D,Bernatik T,et al.Echo-enhanced color-and power-Doppler EUS for the discrimination between focal pancreatitis and pancreatic carcinoma.Gastrointest Endosc,2001,53:784-789.
4.Giovannini M.Endosonography:new developments in 2006.Scientific World J,2007,7:341-363.
5.Giovannini M.Contrast-enhanced endoscopic ultrasound and elastosonoendoscopy.Best Pract Res Clin Gastroenterol,2009,23:767-779.
6.GiovanniniM.Contrast-enhanced and 3-dimensional endoscopic ultrasonography.Gastroenterol Clin North Am,2010,39:845-858.
7.Kitano M,Sakamoto H,Matsui U,et al.A novel perfusion imaging technique of the pancreas:contrast-enhanced harmonic EUS(with video).Gastrointest Endosc,2008,67:141-150.
8.Dietrich CF,Ignee A,Hocke M,et al.Pitfalls and artifacts using contrast enhanced ultrasound.ZGastroenterol,2011,49:350-356.
9.Dietrich CF.Liver tumor characterization—comments and illustrations regarding guidelines.Ultraschall Med,2012,33 Suppl 1:S22-S30.
10.Hocke M,Schulze E,Gottschalk P,et al.Contrast-enhanced endoscopic ultrasound in discrimination between focal pancreatitis and pancreatic cancer.World J Gastroenterol,2006,12(2):246-250.
11.Kanamori A,Hirooka Y,Itoh A,et al.Usefulness of contrast-enhanced endoscopic ultrasonography in the differentiation betweenmalignant and benign lymphadenopathy.Am JGastroenterol,2006,101(1):45-51.
12.Sakamoto H,Kitano M,Suetomi Y,et al.Utility of contrast-enhanced endoscopic ultrasonography for diagnosis of small pancreatic carcinomas.Ultrasound Med Biol,2008,34:525-532.
13.Kitano M,Kudo M,Yamao K,et al.Characterization of small solid tumors in the pancreas:the value of contrast-enhanced harmonic endoscopic ultrasonography.Am JGastroenterol,2012,107:303-310.
14.项明慧,任卫东.临床超声造影诊断图谱.沈阳:辽宁科学技术出版社,2007:12-13.
15.Dietrich CF,Sharma M,Hocke M.Contrast-enhanced endoscopic ultrasound.Endosc Ultrasound,2012,1(3):130-136.
16.Dietrich CF,Ignee A,Braden B,etal.Improved differentiation of pancreatic tumors using contrast-enhanced endoscopic ultrasound.Clin Gastroenterol Hepatol,2008,6:590-597.
17.Kwek BE,Ang TL,Seo DW,et al.Contrast-enhanced harmonic endoscopic ultrasonography of solid pancreatic lesions.Endosc Ultrasound,2013,2(3):142-147.
18.Dietrich CF,Jenssen C,Hocke M,etal.Imaging of gastrointestinal stromal tumourswithmodern ultrasound techniques-a pictorial essay.Z Gastroenterol,2012,50:457-467.
19.Dietrich CF,Ignee A,Barreiros AP,et al.Contrast-enhanced ultrasound for imaging of adrenal masses.Ultraschall Med,2010,31:163-168.
20.Dietrich CF,Braden B,Hocke M,et al.Improved characterisation of solitary solid pancreatic tumours using contrast enhanced transabdominal ultrasound.J Cancer Res Clin Oncol,2008,134:635-643.
21.Dietrich CF,Ignee A,Braden B,etal.Improved differentiation of pancreatic tumors using contrast-enhanced endoscopic ultrasound.Clin Gastroenterol Hepatol,2008,6:590-597.
22.Piscaglia F,Nolsoe C,Dietrich CF,et al.The EFSUMB Guidelines and Recommendations on the Clinical Practice of Contrast Enhanced Ultrasound(CEUS):update 2011 on non-hepatic applications.Ultraschall Med,2012,33:33-59.
23.Dietrich CF,Jenssen C.[Evidence based endoscopic ultrasound].Z Gastroenterol,2011,49:599-621.
24.Dietrich CF,Jenssen C,Hocke M,etal.Imaging of gastrointestinal stromal tumourswithmodern ultrasound techniques-a pictorial essay.ZGastroenterol,2012,50:457-467.
25.Dietrich CF.[Gastrointestinal ultrasound update 2011].Praxis(Bern 1994),2012,101:239-250.
26.Choi JH,Seo DW,Choi JH,et al.Utility of contrast-enhanced harmonic EUS in the diagnosis of malignant gallbladder polyps(with videos).Gastrointest Endosc,2013,78(3):484-493.
27.Girlich C,Schacherer D,Jung EM,et al.Comparison between quantitative assessment of bowel wall vascularization by contrast enhanced ultrasound and results of histopathological scoring in ulcerative colitis.Int J Colorectal Dis,2012,27(2):193-198.
28.De Franco A,Di Veronica A.Armuzzi A,etal.Ileal Crohn disease:muralmicrovascularity quantified with contrast-enhanced US correlates with disease activity.Radiology,2012,262(2):680-688.
29.Jang SI,Lee DK.Contrast-enhanced endoscopic ultrasonography:advance and current status.Ultrasonography,2014,33(3):161-169.
30.Hocke M,Schulze E,Gottschalk P,et al.Contrast enhanced endoscopic ultrasound in discrimination between focal pancreatitis and pancreatic cancer.World J Gastroenterol,2006,12:246-250.
31.Fusaroli P,Spada A,Mancino MG,etal.Contrastharmonic echo-endoscopic ultrasound improves accuracy in diagnosis of solid pancreatic masses.Clin Gastroenterol Hepatol,2010,8:629-634.
32.Becker D,Strobel D,Bernatik T,et al.Echo-enhanced color and power-Doppler EUS for the discrimination between focal pancreatitis and pancreatic carcinoma.Gastrointest Endosc,2001,53:784-789.
33.Imazu H,Uchiyama Y,Matsunaga K,et al.Contrast-enhanced harmonic EUSwith novel ultrasonographic contrast(Sonazoid)in the preoperative T-staging for pancreaticobiliarymalignancies.Scand JGastroenterol,2010,45:732-738.
34.Hirooka Y,Itoh A,Kawashima H,et al.Contrast-enhanced endoscopic ultrasonography in digestive diseases.J Gastroenterol,2012,47:1063-1072.
35.Saftoiu A,Gheonea DI.Tridimensional(3D)endoscopic ultrasound:a pictorial review.J Gastrointestin Liver Dis,2009,18:501-505.
36.Hocke M,Dietrich CF.New technology:combined use of 3D contrast enhanced endoscopic ultrasound techniques.Ultraschall Med,2011,32:317-318.