第八章
腹腔镜抗胃食管反流手术
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃内容物反流至食管、口腔(包括咽喉)和(或)肺导致的一系列症状、终末器官效应和(或)并发症。GERD的消化系统症状包括反酸、反食、胃灼热、嗳气、胸背痛、腹胀、吞咽困难等,但显得更为重要的是其食管外表现,包括咽异物感、咽喉疼痛、声音嘶哑、鼻塞、流涕、口腔溃疡、咳嗽、咳痰、喘息、憋气以至窒息等。
GERD在全球有较高的患病率,但具有一定的地区差异性,就GERD的典型症状(如反流、胃灼热等)而言,患病率在北美为18.1%~27.8%,南美约为23.0%,欧洲为8.8%~25.9%,中东为8.7%~33.1%,澳洲约为11.6%,亚洲为6%~10%。1999年北京和上海两地同时进行的调查显示GERD患病率为5.77%,而随着国人生活水平提高和饮食结构改变,预计我国GERD的发病率将会逐渐上升。
胃食管反流症状可造成明显不适,保守治疗可能要求部分患者终生改变生活方式并长期服用药物,导致降低生活质量,并带来较大经济负担。上海的一项研究显示GERD影响47%患者的饮食,32%患者的睡眠,以及32%患者的工作能力,对患者的健康状况和情绪均有负面影响。
一直以来,GERD被认为是内科疾病,以药物治疗为主。大部分GERD患者药物治疗有效,但部分患者难以永久停药,多采用维持治疗或按需治疗,另有部分患者仅可部分缓解,而难以控制症状,伴食管外症状的患者则更难以靠药物取得满意疗效,故外科抗反流手术成为进一步治疗的选择。外科手术的原理是修复胃食管交界处抗反流屏障,理论上可持久控制任何形式的反流,实践证明符合手术适应证的GERD患者可获得良好的有效性、安全性和满意度。
【GERD发病机制】
1.胃食管接合部的抗反流屏障功能削弱
是本病发生的根本机制。胃食管接合部的抗反流屏障功能主要包括:①下食管括约肌形成高压带,阻止胃内容物反流;②膈肌脚对下食管括约肌的外压迫作用;③食管与胃底间的锐角(His角)形成活瓣,在胃内压升高时起关闭作用。抗反流屏障功能减弱主要表现在以下几个方面:①食管裂孔疝破坏了解剖学结构;②不伴有解剖结构异常的一过性下食管括约肌松弛增加;③食管下括约肌压力降低和(或)食管裂孔功能不全。
2.食管对反流物的清除能力下降
食管清除主要借助于食管蠕动、重力作用和唾液、食管内黏液的中和等,其中食管蠕动为最主要的清除方式。
3.胃排空障碍
胃排空延迟使胃内压力升高,使胃内容物容易进入食管。
4.反流物的攻击作用
反流物刺激食管黏膜和食管外部位,损伤食管和食管以外部位黏膜,主要损伤因素包括胃酸、胆汁及各种消化酶。
5.反流导致食管外症状的可能机制
①反流物通过咽喉部形成微喷射机制,可形成细颗粒或雾状物而被喷至咽喉部、口腔、鼻腔、中耳,并可吸入气管、支气管和肺部,反流物中的酸性物质、胆汁及各种消化酶对这些部位的黏膜造成强烈刺激,引起咳嗽、喉痉挛、气管痉挛、咽异物感、痰液分泌增多、鼻涕、鼻塞、喷嚏、耳鸣、耳痒等症状;②食管-支气管反射,远端食管酸化时,刺激食管的化学感受器触发迷走反射,引起支气管收缩;③来自食管的炎性介质影响呼吸功能;④食管敏感神经将刺激传入中枢,诱发气道高反应性,在这些患者中,即使酸反流很少,也能引起支气管痉挛,这是不少患者抗酸疗效不佳的原因之一,且大部分患者内镜检查阴性,甚至部分患者食管pH检测亦在正常范围。
【病理】
GERD的组织病理学改变包括一系列提示上皮损害和修复的特征,复层鳞状上皮基底细胞层增生增厚超过整个上皮厚度的15%(增生超过3层);黏膜固有层乳头向上皮腔内延长大于上皮厚度的2/3,浅层毛细血管扩张,充血和(或)出血;固有层内炎性细胞浸润,主要是中性粒细胞和淋巴细胞;糜烂及溃疡;胃食管交界处以上出现Barrett食管改变,即食管下段正常的复层鳞状上皮被单层柱状上皮替代,可伴有或不伴肠化生,根据病变长度,以3cm为界,分为长段Barrett食管和短段Barrett食管两种类型。
【术前检查】
1.内镜检查该方法可以明确有无反流性食管炎及其程度,是否伴有食管裂孔疝,是否出现胃食管反流病的并发症,如食管溃疡、狭窄、食管癌等。胃食管反流病根据其内镜下表现可以分为非糜烂性胃食管反流病、反流性食管炎和Barrett食管。 非糜烂性胃食管反流病(non-erosive reflux disease,NERD)是指有典型的GERD症状,但内镜检查无食管黏膜破损,据报道70%的胃食管反流病属于NERD。反流性食管炎的分级法多采用洛杉矶标准:A级,一个或一个以上食管黏膜破损,长径<0.5cm;B级,一个或一个以上食管黏膜破损,长径>0.5cm,但相互不融合;C级,病变在黏膜顶部有融合,累及部分食管壁;D级,病灶出现相互融合,而且病变至少累及75%以上的食管壁全周。
2.X线钡餐造影传统的食管钡餐检查将胃食管影像学和动力评估结合起来,可显示有无黏膜病变、狭窄及食管裂孔疝等,并显示有无钡剂的胃食管反流,诊断上有互补作用,但灵敏度较低。
3.同位素扫描令患者平卧位饮下用同位素 99m 锝标记的试验餐,在闪烁照相机下进行扫描,以定量地发现胃食管反流。扫描时可采用一些促使反流的方法,以提高阳性率,如Valsalva试验和腹部缚腹带加压。该法的不足之处是敏感性和特异性不够高,目前多被食管pH监测代替,但如果在肺内发现同位素分布,则是食管外反流的有利证据。
4.食管24小时pH监测该法目前仍是诊断胃食管反流病的金标准。正常情况下食管pH>4,而胃内pH<3,所以放置电极在食管内,若食管内pH<4,则提示有胃酸反流入食管。正常人也会有生理性的酸反流,达到一定程度即可诊断为胃食管反流病。24小时食管pH监测能详细显示酸反流、昼夜酸反流规律、酸反流和症状的关系及对治疗的反应,有利于治疗个体化。
5.多通道腔内阻抗技术其优点是可监测出所有的反流事件,明确反流物的性质(气体、液体或气液混合物),与食管pH监测联合应用可以明确反流物为酸性或非酸性,明确反流物与反流症状的关系。
6.食管测压食管测压,特别是高分辨率食管测压能帮助评估食管体部的蠕动功能及下食管括约肌的压力,外科医生还可以根据测压结果来选择手术方法,在食管运动功能正常的患者可选择Nissen手术,对食管蠕动功能减弱的患者宜采用Toupet手术或Dor手术。另外,高分辨率食管测压还可以通过下食管括约肌区域两个压力带的分离来诊断食管裂孔疝。
7.食管胆汁反流测定部分GERD患者有非酸性反流物因素的参与,特别是与胆汁反流相关。可通过检测胆红素来反映胆汁反流存在与否和其程度。但多数十二指肠内容物的反流与胃内容物的反流同时存在,并在抑酸后症状有所缓解,因此胆汁反流检测的应用有一定局限性。
8.对拟诊患者或怀疑反流相关食管外症状的患者,尤其是上消化道内镜检查阴性时,可采用诊断性治疗。 质子泵抑制剂诊断性治疗(PPI试验)已被证实是行之有效的方法。建议用标准剂量PPI,1天2次,疗程1~2周。如服药后症状明显改善,则支持为与酸相关的GERD,如服药后症状改善不明显,则可能有酸以外的因素参与,或不支持诊断。本试验的优点是方便、无创、灵敏度高,缺点是特异性较低。
【适应证】
1.诊断明确的GERD患者,经系统而充分的药物治疗,历时半年以上,仍不能完全控制反流症状或消除并发症。
2.药物治疗有效,但患者要求进一步积极治疗,包括要求改善生活质量、不愿终生服药或出现药物副作用。
3.经咽部或食管内反流监测证实,反复发作的咽喉部或肺部症状与反流相关,且药物治疗效果不佳者。
4.GERD出现严重并发症,如Barrett食管有癌变倾向,重度食管炎形成食管狭窄,需反复扩张者。
5.食管裂孔疝合并胃食管反流病,且伴有疝本身引起的症状,如胸闷气促、上腹胀、呕吐、贫血等,不能用抗反流药物治疗缓解者。
【禁忌证】
1.合并心肺疾病不能行气管插管全身麻醉者。
2.未经过充分内科治疗者。
3.诊断不明确,症状是否由胃食管反流引起尚难肯定,不能排除胃肠动力性疾病或功能性疾病。
4.无症状的食管裂孔疝。
【术前准备】
1.纠正全身状况,调节水、电解质平衡,对于合并哮喘等呼吸道症状的患者术前强化内科治疗,使患者呼吸功能达到最佳状态。
2.术前禁食水8小时,术前晚清洁肠道。
3.术前留置尿管、胃管。
【手术器械】
30°腹腔镜、超声刀、Babcock钳、无损伤抓钳、肠钳、分离钳、持针器、剪刀、吸引器。
【麻醉】
气管插管全身麻醉。
【体位和套管位置】
患者取20°~45°反Trendelenburg体位(头高脚低位),双上肢置身旁,用压手单固定,或外展固定于托板上,两下肢外展,为防止患者从手术台上滑落,必须将患者两腿妥善固定于手术床上(图8-1)。也有选择截石位者,但必须注意髋部屈曲不能超过20°,以避免影响第一助手器械的操作。术者站立于患者两腿之间,第一助手位于患者左侧,扶镜手位于患者右侧,器械护士位于患者足侧(图8-2)。
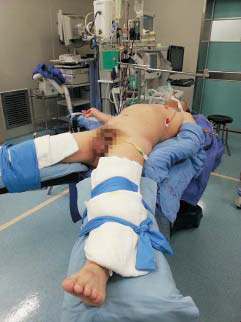
图8-1 手术体位
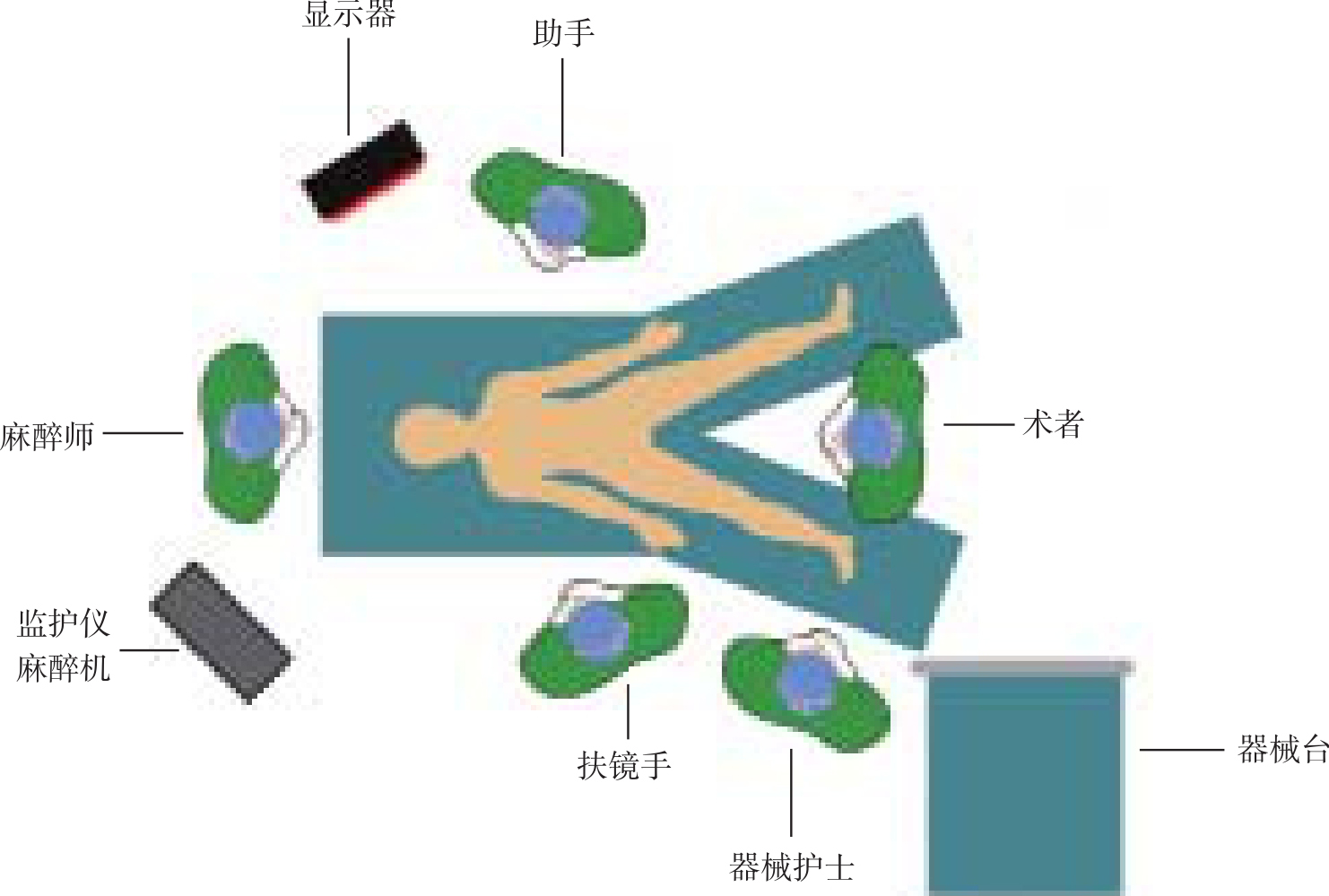
图8-2 手术室布局
套管位置有几种不同方案,常用套管位置如图所示(图8-3)。腹腔镜镜头通常自脐上套管孔置入,若患者体型较长,或术前判断食管裂孔疝巨大,可能需要深入至纵隔内分离时,为避免腹腔镜长度不够的问题,可以根据患者的体型和裂孔疝大小,将观察孔改在脐与剑突连线中点以下的不同位置。术者主操作孔(10mm)设置在左锁骨中线肋缘下2cm,次操作孔(5mm)设在右锁骨中线肋缘下2cm。助手操作孔(5mm)设置在左侧腋前线脐水平。剑突下孔(5mm)置入托肝器械。
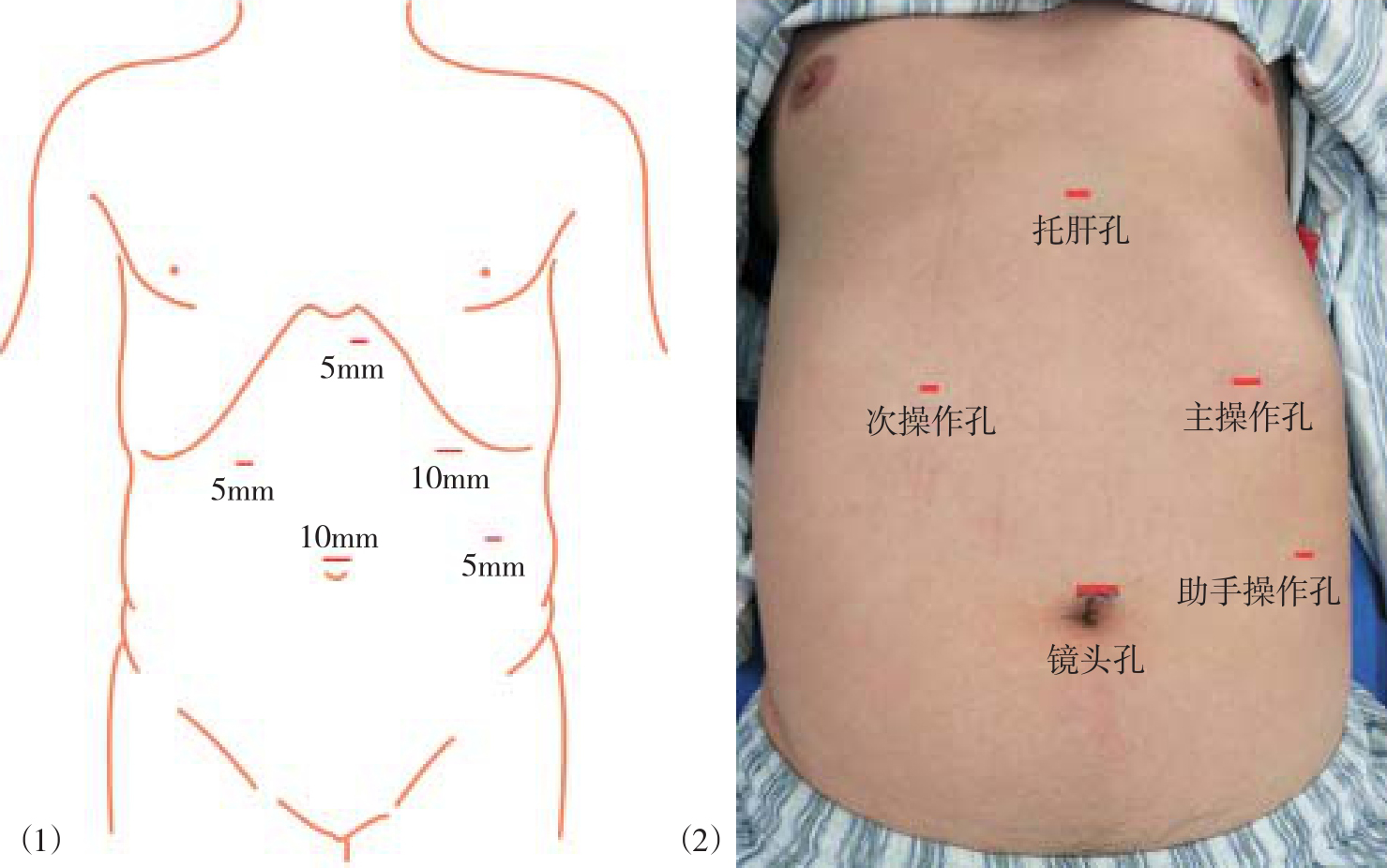
图8-3 常用套管位置
【手术步骤】
1.进入腹腔探查后,自剑突下套管伸入Babcock钳夹住膈裂孔上方组织,借助钳杆将左肝托起以暴露术野,也可以使用肺叶拉钩或扇形牵引器托起左肝(图8-4)。气腹压力维持在12~15mmHg。
2.第一助手用无损伤肠钳夹持肝胃韧带向左下牵拉,自肝尾状叶前方透明薄层无血管区开始,用超声刀逐段向头侧切开(图8-5)。大部分患者肝胃韧带内可见一支走向左肝的动脉,往往与迷走神经肝支伴行,若动脉直径小于3mm,可以用超声刀直接切断或结扎后切断,若直径超过3mm,建议将之保留。切开右侧膈食管膜,游离食管右侧壁、前壁和后壁(图8-6),显露迷走神经后支以及左右膈肌脚汇合处,沿左膈肌脚表面游离食管后方窗孔(图8-7)。
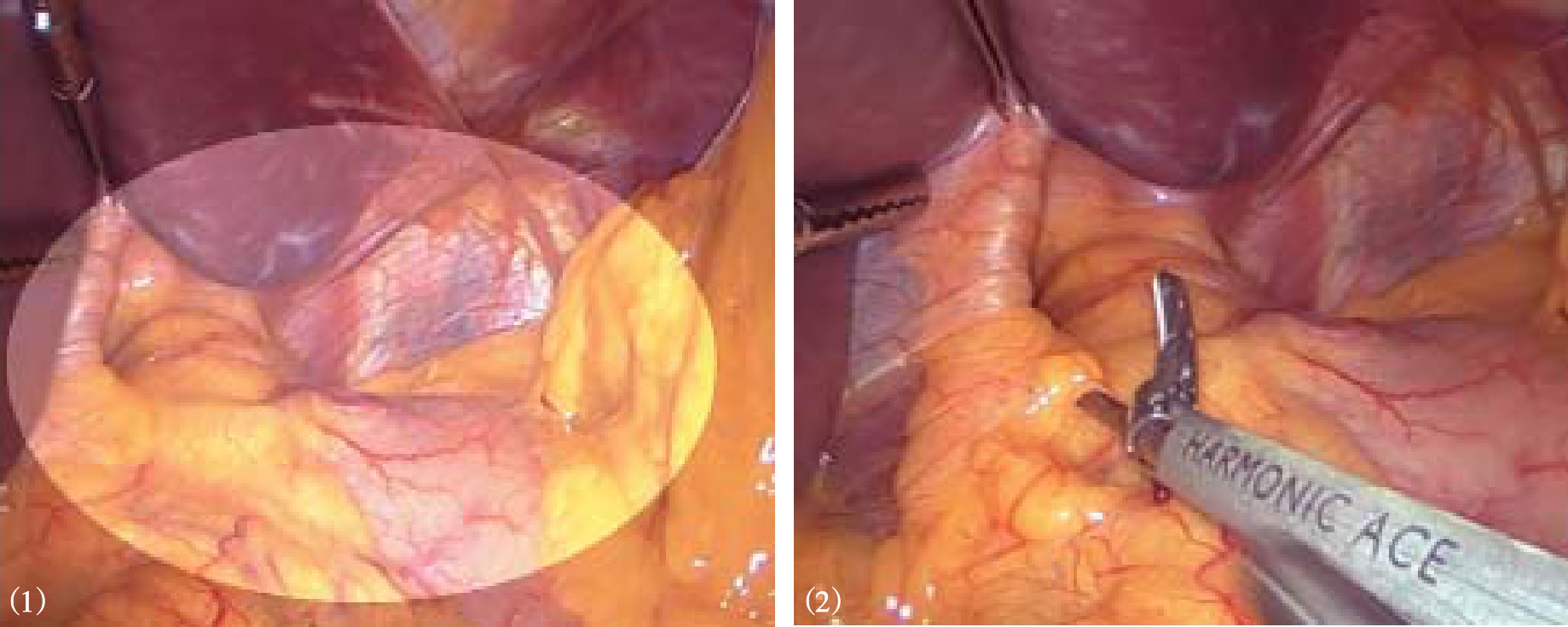
图8-4 显露术野
3.术者用5mm无创钳将远侧胃底部向患者右侧腹方向牵引,助手将脾胃韧带向左侧牵拉,从胃底体交界处靠近胃壁切开脾胃韧带,依次向上分离并切断胃短血管,注意避免损伤脾及胰体尾(图8-8)。部分肥胖患者的脾胃韧带很肥厚,脾上极暴露困难,此时需在左上腹置入第6个套管,以便再置入器械协助获得较好暴露。游离膈胃韧带、胃食管接合部与膈肌之间的韧带和脂肪组织(图8-9)。将胃近端向右下牵拉,分离左侧膈食管膜,继续游离食管的左缘和后方,于食管后方分离出一个间隙,可达6cm以上(图8-10)。游离食管前方,注意辨认和保护前迷走神经,切除胃食管交界部左前方脂肪,避免该处过多脂肪影响胃底折叠(图8-11)。继续向后纵隔方向游离近端食管,以使腹腔内无张力食管达5~6cm。若腹段食管过短,一般都能够通过在纵隔内游离近端食管,达到延长腹段食管的目的。
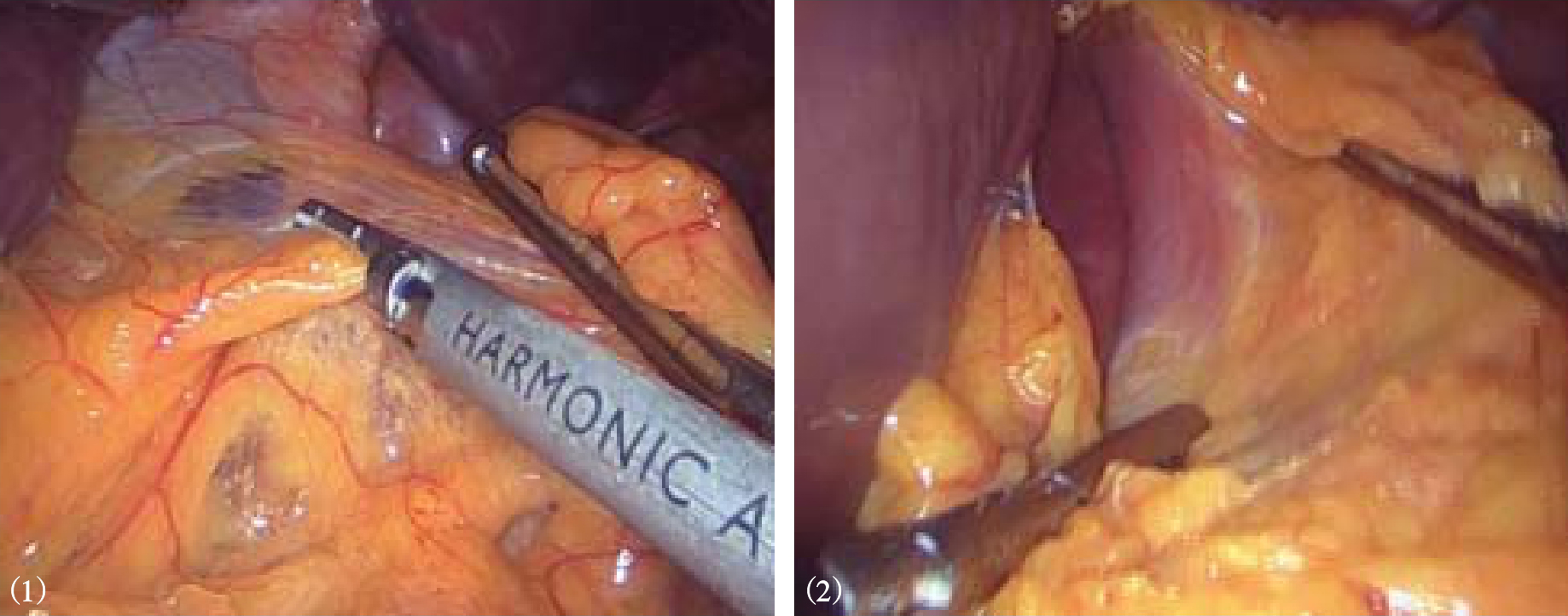
图8-5 切开肝胃韧带
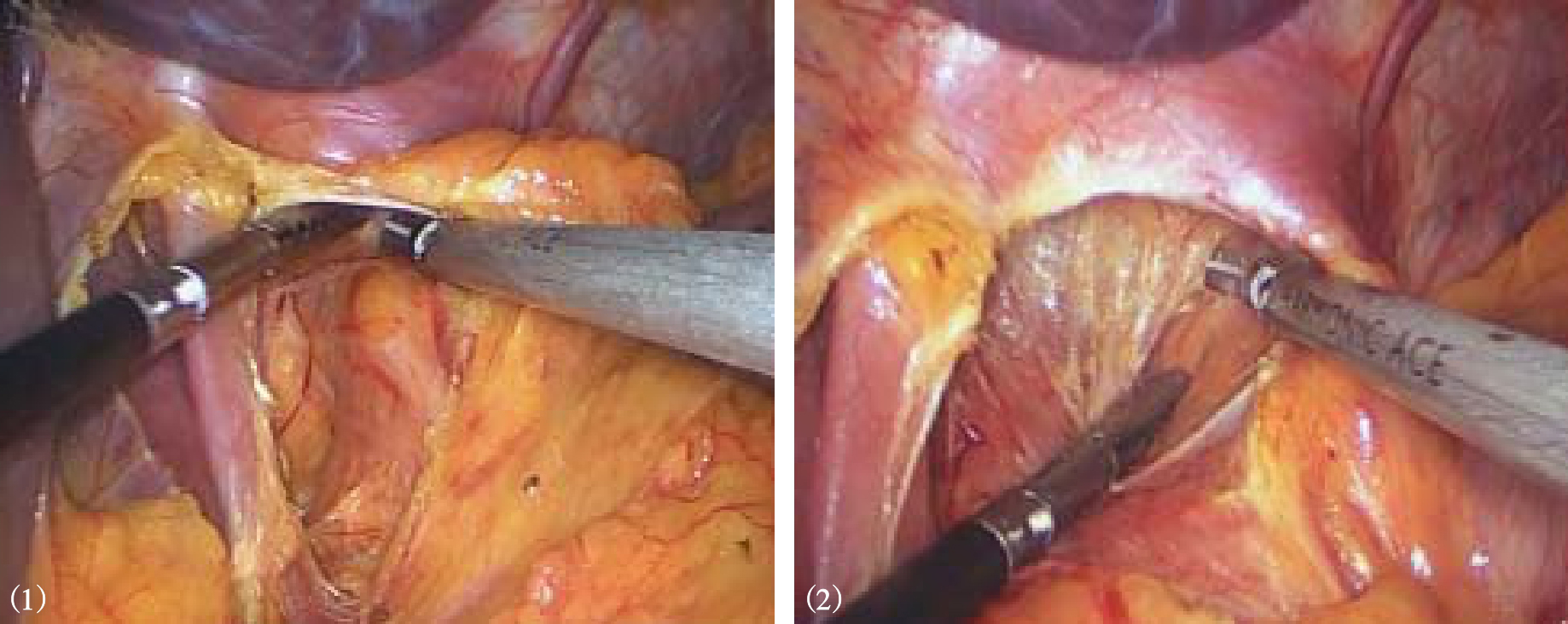
图8-6 切开右侧膈食管膜,游离食管右侧

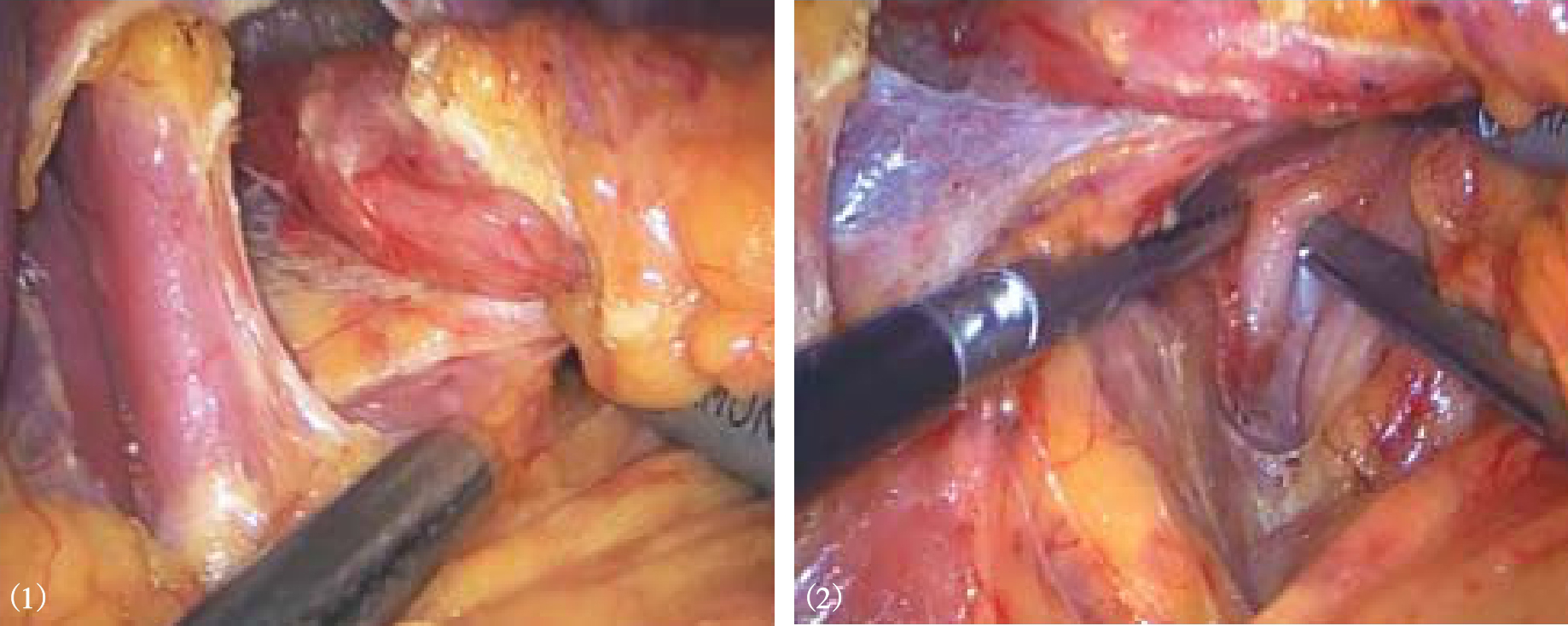
图8-7 显露迷走神经后支以及左右膈肌脚

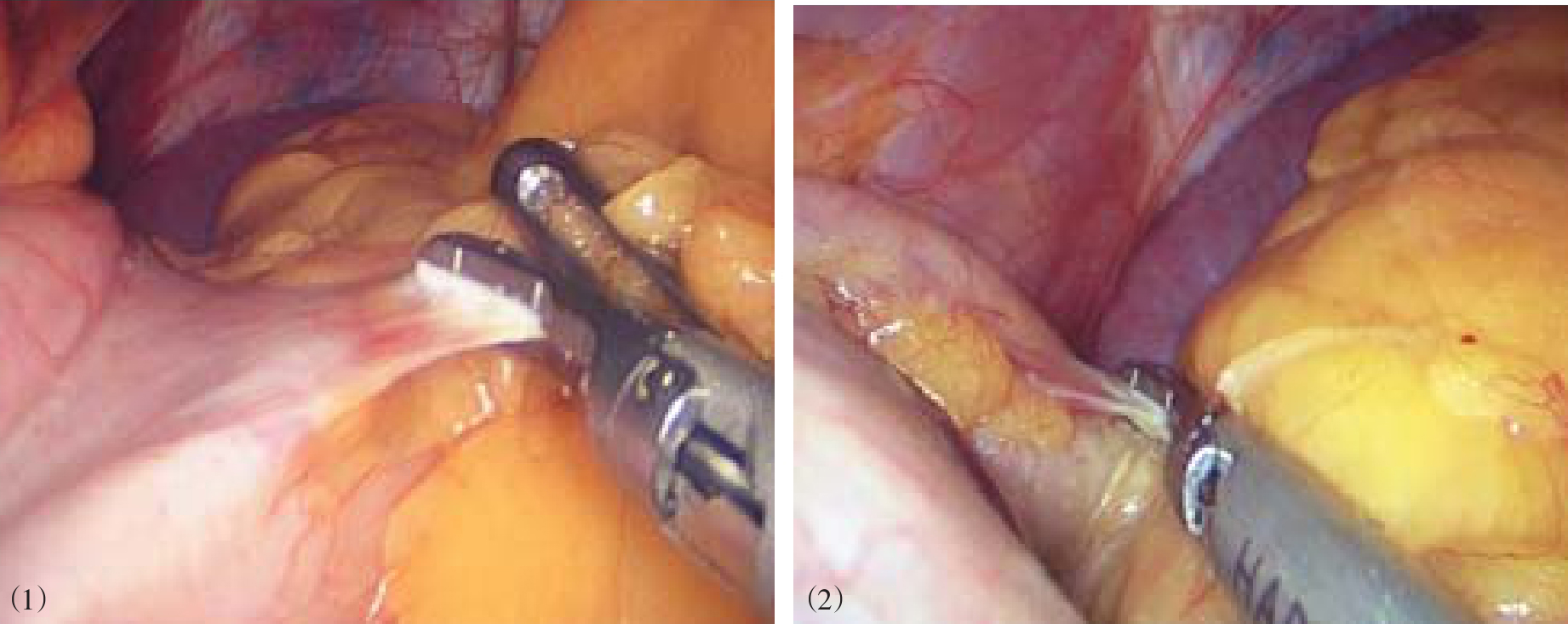
图8-8 切开脾胃韧带
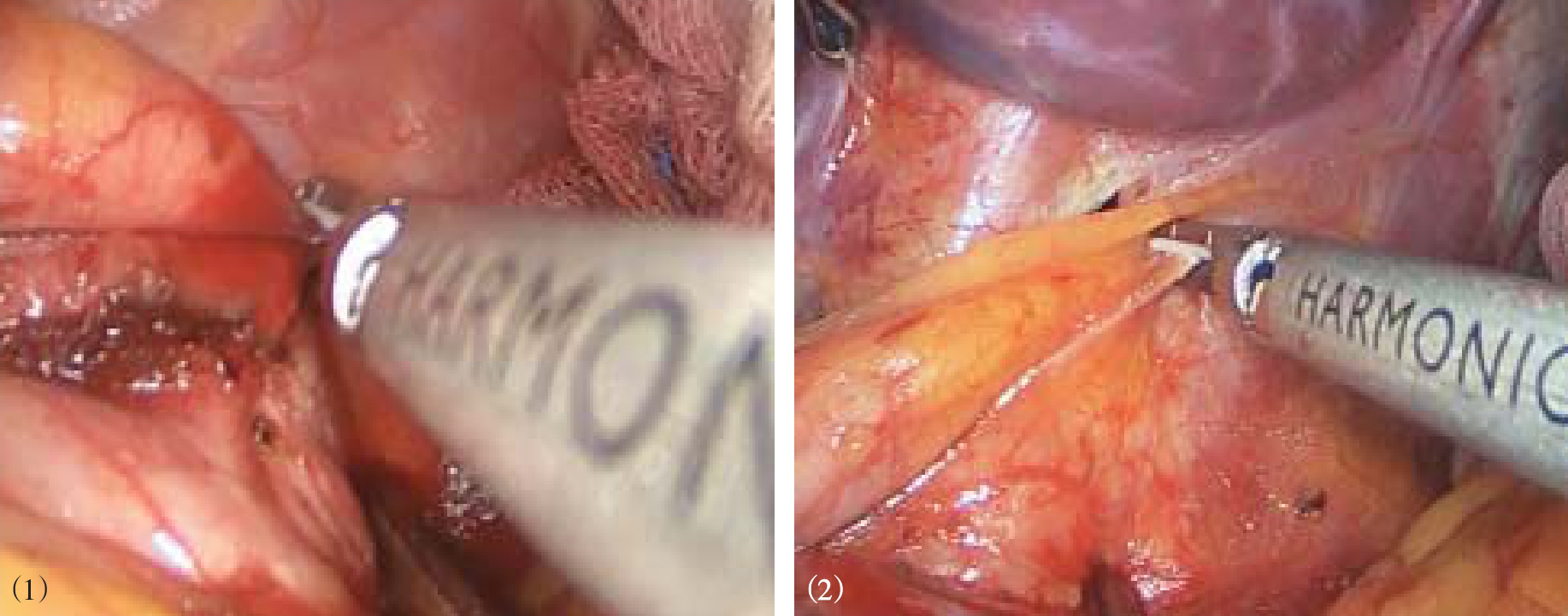
图8-9 游离膈胃韧带、胃食管接合部与膈

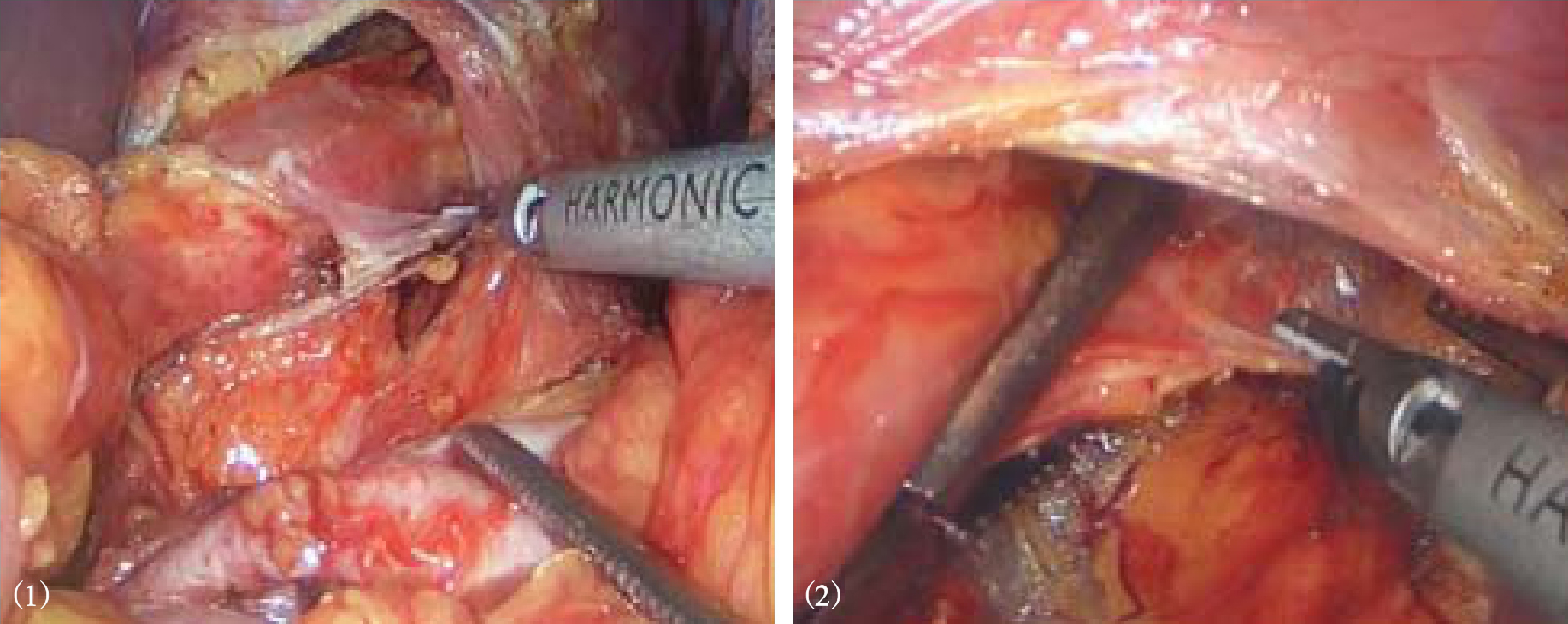
图8-10 游离食管左侧和后方
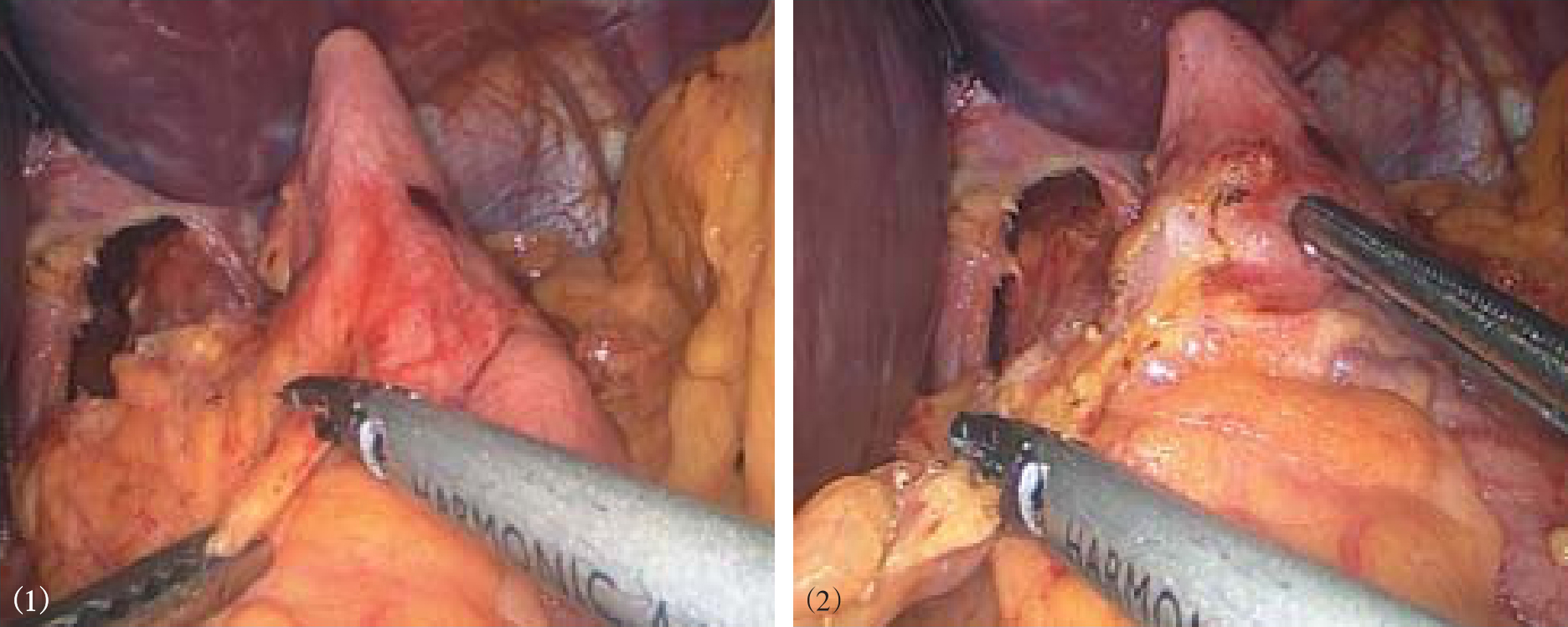
图8-11 游离食管前方
4.将一条纱带或细引流管通过食管后方牵拉食管,将食管拉向左前腹壁,暴露食管裂孔,2-0不可吸收丝线间断缝合两侧膈肌脚,缩小膈食管裂孔,最上方一针距离食管0.5~1.0cm,以避免术后狭窄(图8-12)。当裂孔前后径达5cm以上,为减少裂孔缝合张力,减少复发,可在裂孔缝合后放置补片(生物补片或合成补片),可吸收钉固定(图8-13)。
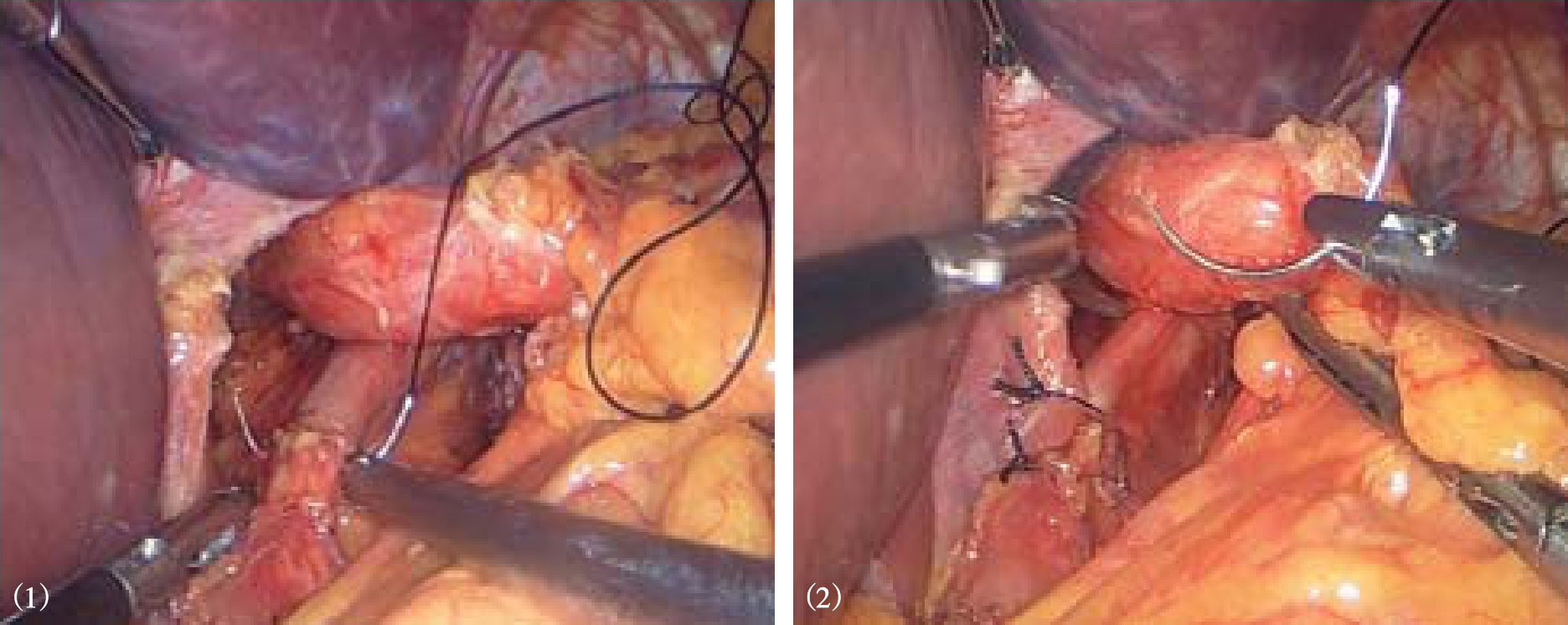
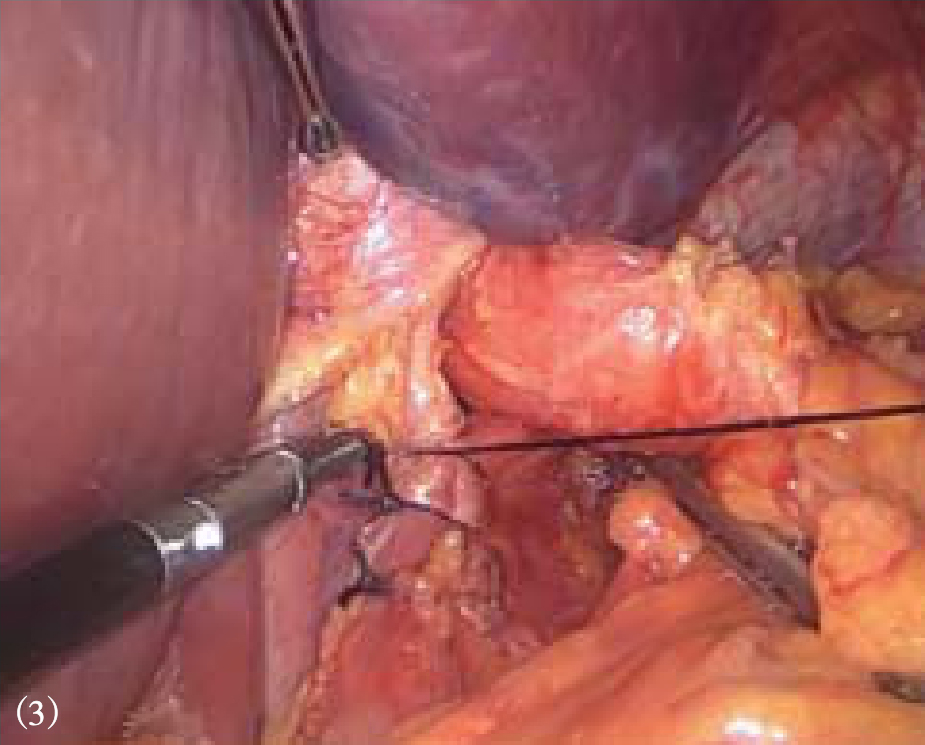
图8-12 间断缝合缩小膈食管裂孔
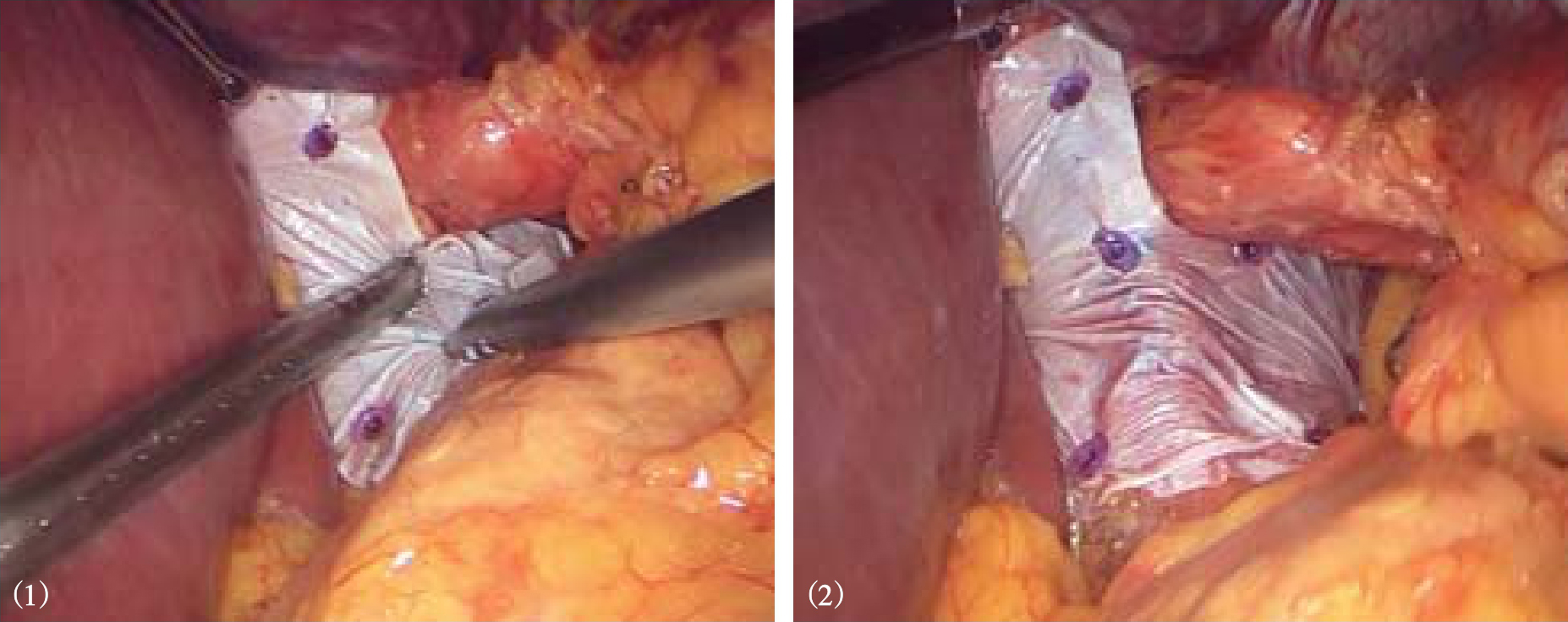
图8-13 放置补片
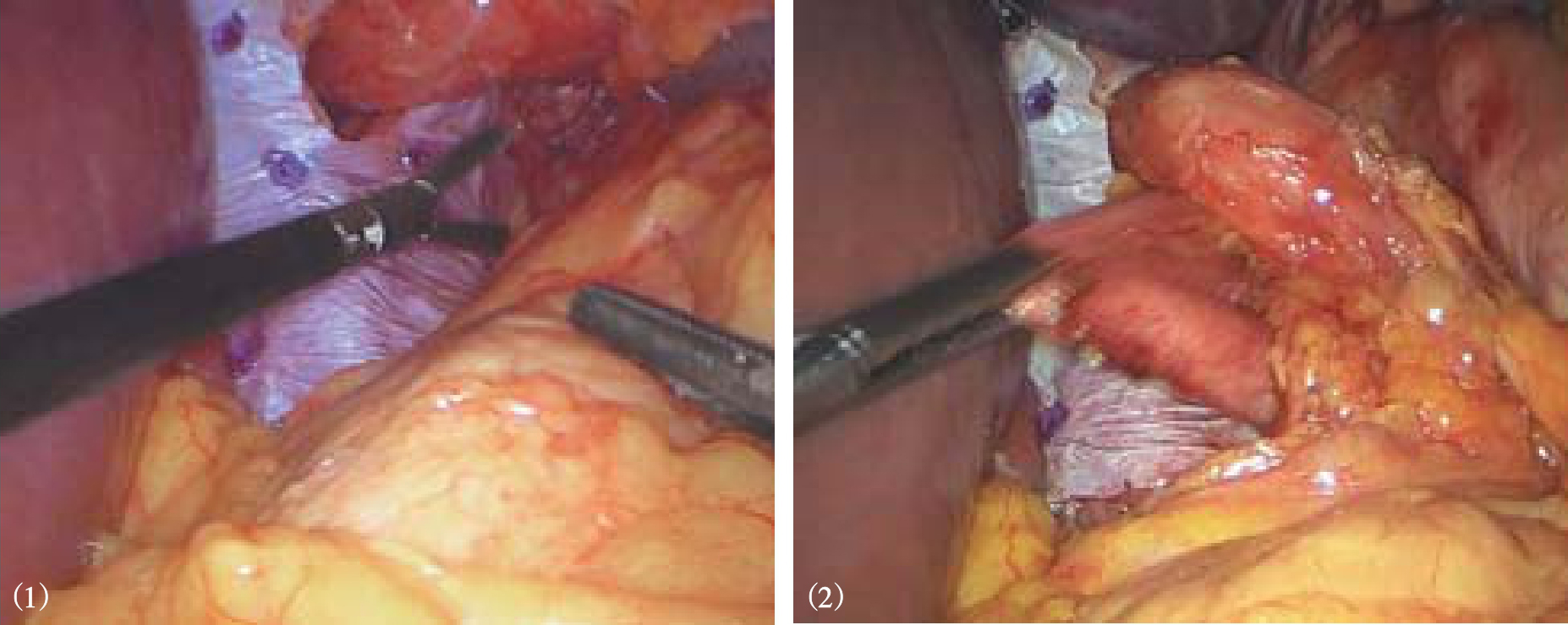
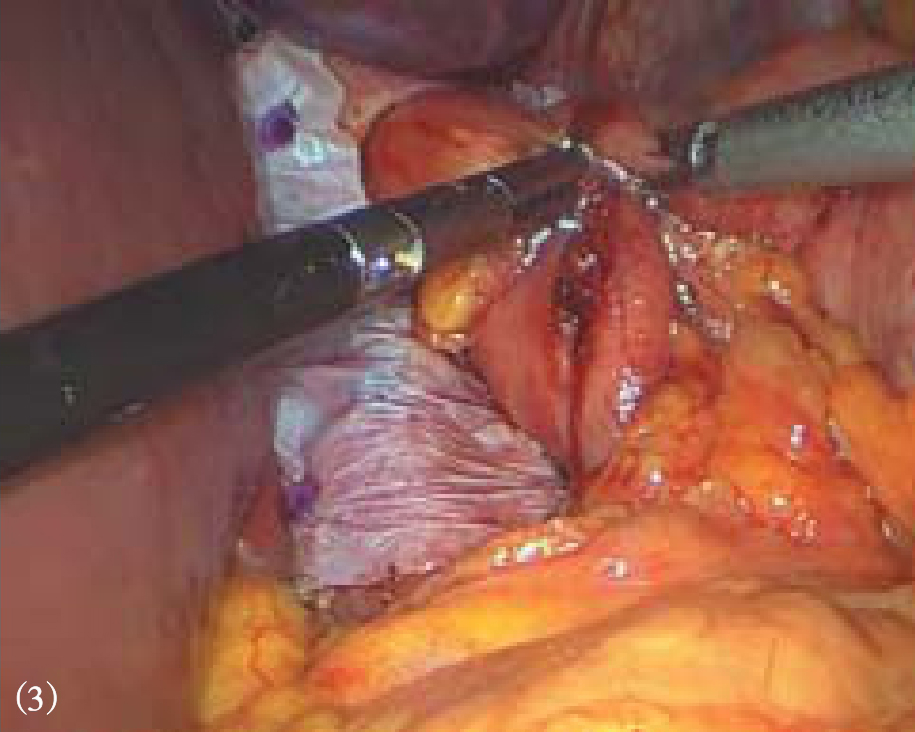
图8-14 Nissen胃底折叠
5.完成胃底折叠 在食管后方用无损伤钳抓住胃底将其拉向右侧,完成Nissen或Toupet胃底折叠(视频1)。胃底折叠根据胃底包裹食管的多少分为全胃底折叠和部分胃底折叠。 全胃底折叠主要指 Nissen胃底折叠,一般主张做一个1.5~2.5cm宽度的松、短折叠,即将胃底包绕食管360°,在食管前间断缝合两侧胃底组织2~3针,其中至少有1针与食管壁进行缝合,缝合后折叠瓣与食管之间可以轻松通过5mm直径的操作钳(图8-14、图8-15)。 部分胃底折叠主要指Toupet或Dor胃底折叠, Toupet术是将胃底包绕食管180°~270°,并分别将两侧胃底与食管前壁间断缝合2~3针,食管前壁有90°~180°未有胃底包裹(图8-16、图8-17)。 Dor术并不需要制造食管后方窗口,也不需要切断脾胃韧带,只需将胃底前壁直接覆盖在食管前方,缝合固定在膈食管裂孔顶端和右侧膈肌脚上,形成180°前折叠(图8-18)。Nissen和Toupet术都需要将折叠瓣与膈肌充分固定,以避免术后折叠瓣移位,导致纵隔内造成医源性食管裂孔疝。我中心一般将折叠瓣的后壁与膈肌脚纵向固定两针,形成折叠瓣系膜,从而有效阻止折叠瓣移位(图8-17)。
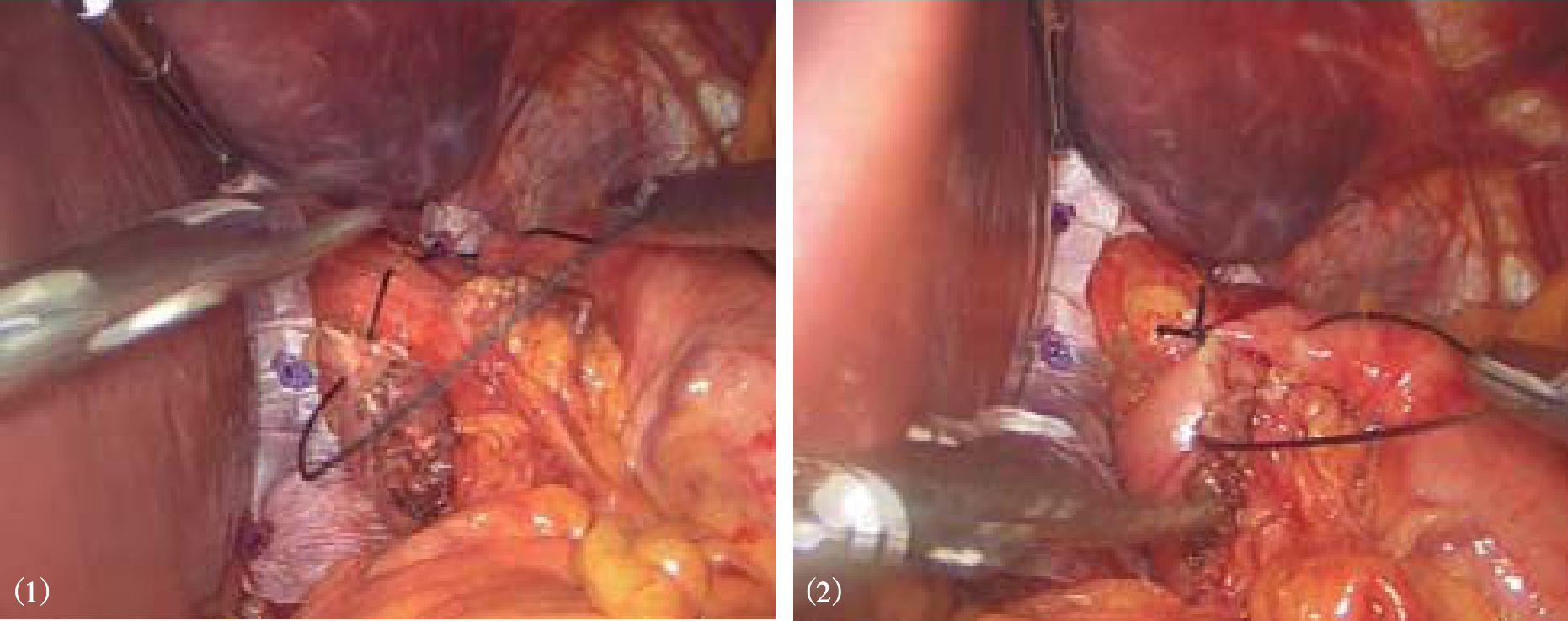
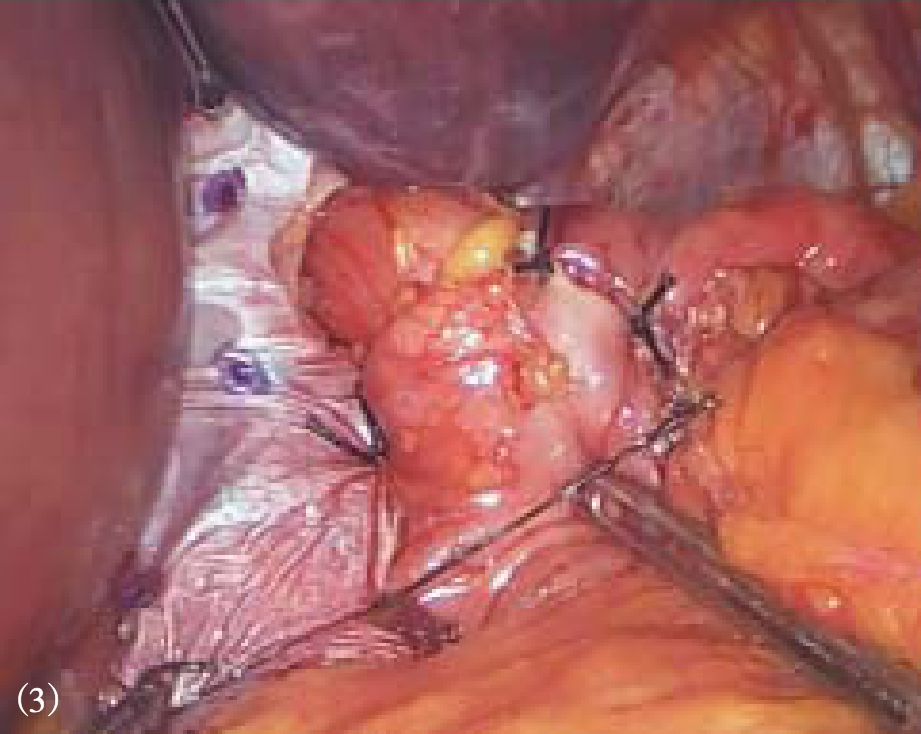
图8-15 Nissen胃底折叠缝合

视频1 (吴继敏 中国人民

(吴继敏 中国人民解放军火箭军总医院)
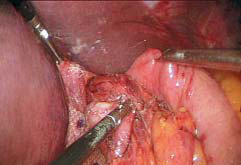
图8-16 Toupet胃底折叠
【要点分析】
1.胃食管反流病是一种功能性疾病,成功的抗反流手术要达到以下五个标准:①恢复正常解剖结构;②要达到减少反流、完全控制症状、停用抗反流药的初衷;③避免发生严重并发症;④保证正常进食功能;⑤允许正常的嗳气和呕吐。因此,外科医生在开展该手术前一定要充分了解贲门区域的解剖学特点、反流机制、胃底折叠抗反流的原理、疝复发原因等,还要具备娴熟的腹腔镜手术技术,术前要充分评估病情,这样才能最大限度地减少手术并发症和复发,达到理想的手术效果。
2.短食管的处理 术中经分离松解后,腹段食管长度仍<2~2.5cm为短食管,而现有的检查难以在术前准确判断。Horvath等把短食管分为三种类型:表观短食管(实际上长度正常,因为纵向压缩和扭曲等原因看起来为短食管);真性可延长短食管(确实为短食管,但经过合理的松解游离后可使腹段食管超过2.5cm);真性不可延长短食管(确实为短食管,经过松解游离后腹段食管仍无法达到2.5cm)。短食管可对完成一个张力适合的胃底折叠造成困难,这一点非常重要,对于手术疗效、术后不适及术后复发有很大影响。经过充分的向近侧松解游离,绝大多数腹段食管长度均可达到要求。若经充分游离,腹段食管长度仍然不够折叠,只能放弃折叠,做简单的解剖结构复位和裂孔修补即可。有些术者会采取Collis-Nissen手术纠治短食管,即在胃食管交接处通过切割闭合器将腹段食管延长,再在延长的腹段食管上做Nissen胃底折叠。
3.术中预防复发的技术要领 ①尽可能充分游离食管,减少食管向上滑动的张力;②缝合缩小膈食管裂孔至适当大小,留0.5~1.0cm的间隙,过于宽松易导致疝形成;③利用合成或生物补片加强修补食管裂孔,在一定程度上能减少因裂孔再次裂开导致的复发;④分离食管的过程在某种意义上造成了膈食管膜更大程度的破坏,所以要重视膈食管膜的重建,我中心一般将食管与膈肌脚缝合固定2~3针,以封闭裂孔及避免食管滑动;⑤折叠瓣与膈肌脚缝合2~3针,防止折叠瓣或胃底组织向裂孔内疝入。
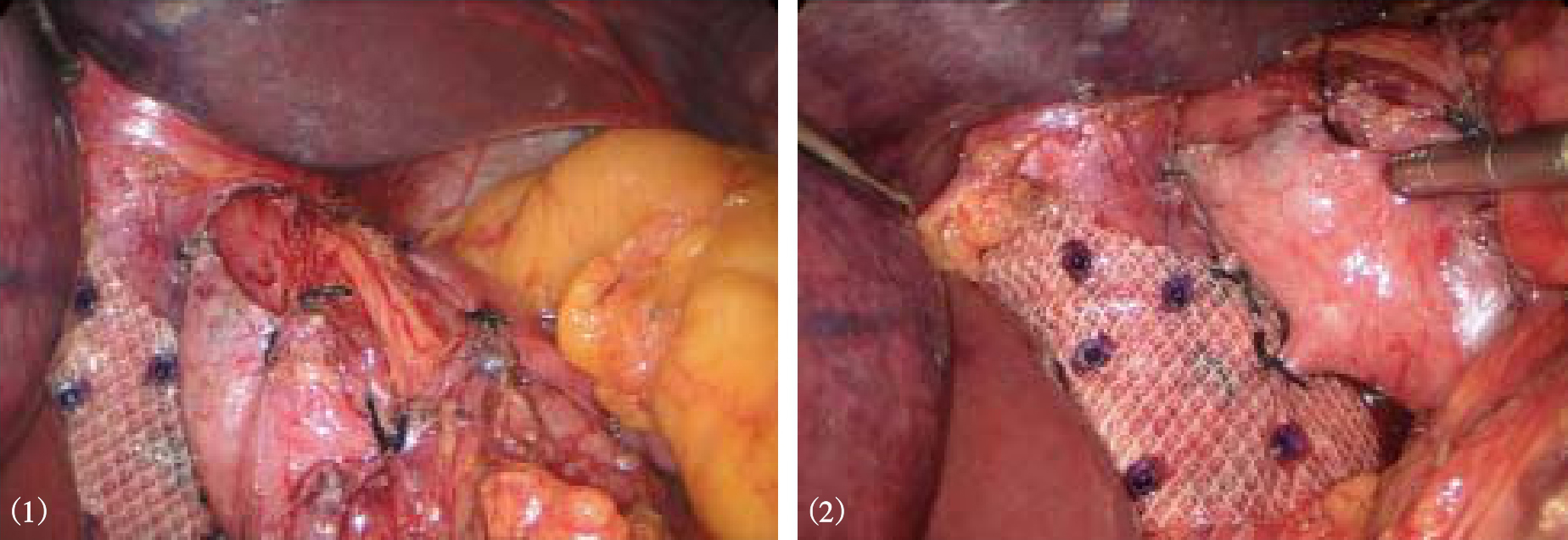
图8-17 Toupet胃底折叠缝合
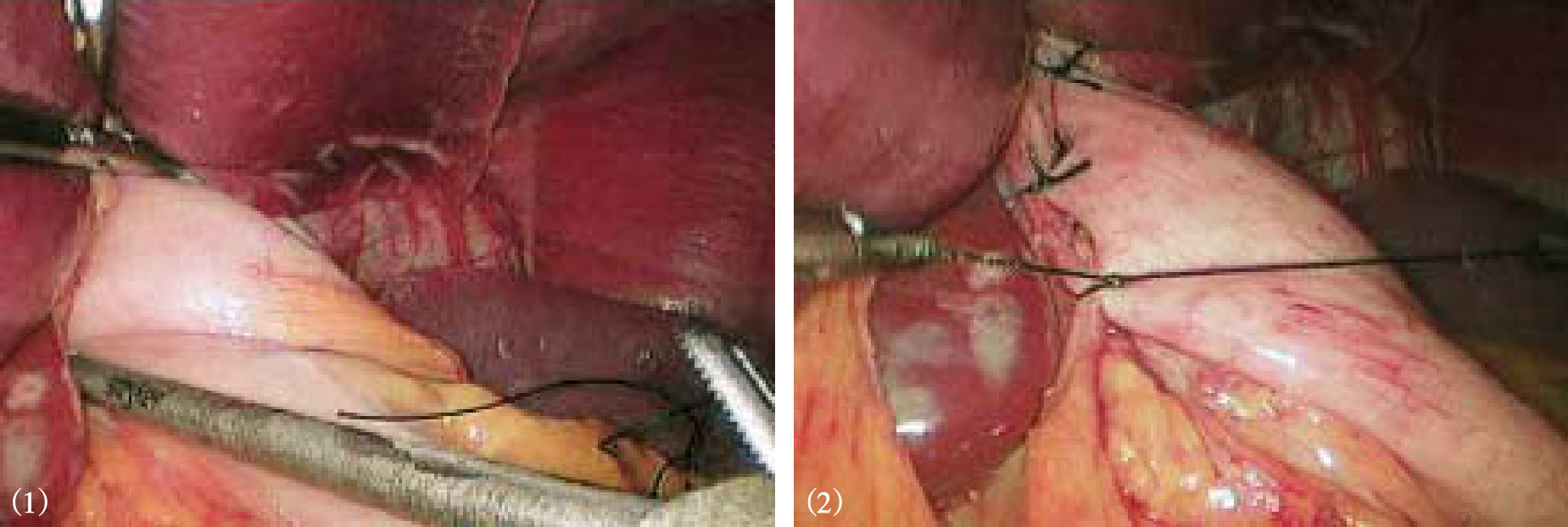
图8-18 Dor胃底折叠术
【术后处理】
1.为减少患者不适,多数情况下术后即可拔除胃管,无须胃肠减压。但若遇到以下情形则需保留胃管:①手术时间很长,超过5小时,估计术后胃肠蠕动恢复较慢;②术中进行过食管或胃穿孔修补,或疑似有小穿孔;③同时进行了其他腹腔镜手术,如胆囊切除术、高选择性迷走神经切断术或幽门成形术等。
2.尿管可留置至第二天上午。
3.术后次日即可进流质饮食,术后第三天可进半流质,根据吞咽困难程度逐渐过渡到软食和普食。因手术区域水肿等原因,部分患者术后会有不同程度的吞咽困难症状,应指导患者细嚼慢咽,不要过快或大口进食,不要进食大块固体食物,如馒头等。
4.术后若出现较严重的吞咽困难,或怀疑有胃食管穿孔,应口服泛影葡胺或碘帕醇进行食管造影检查。
5.止吐、镇咳 早期预防恶心呕吐,积极镇咳,避免腹内压增高造成早期疝复发。
【并发症及防治】
1.术中出血
术中较常见并较危险的出血为胃短血管或脾脏撕裂出血,该处由于位置较深,暴露较困难,再加上脾脏质脆,出血不易控制。一旦发生出血,必须沉着冷静,切忌慌张胡乱钳夹。胃短血管出血往往是由于超声刀止血失败所致,出血后一定要迅速夹住出血点,再施钛夹止血。另外,用超声刀离断胃短血管需靠近胃壁,以免脾侧血管断端回缩造成止血困难。脾脏撕裂出血,包括脾门血管撕裂出血,可用干纱布压迫或止血纱填塞止血,不宜盲目用电凝止血,如出血难以控制,应及时中转开腹手术止血。转开腹后要特别小心保护脾脏,避免脾撕裂加深,尽可能保全脾脏。因良性病变手术而切除脾脏,患者往往很难接受。肝脏出血多因牵拉肝脏的器械不小心戳伤肝脏浆膜所致,伤口往往不会太深,用电钩或电铲止血即可。如仍有出血则用吸收性明胶海绵或止血纱压迫片刻,多数都可止血。我们采用Babcock钳夹住食管裂孔上方组织托起肝脏的方法,由于器械基本固定不动,戳伤肝脏的情形很少发生[图8-13(1)]。
其他少见的出血原因还有腹主动脉和下腔静脉损伤出血。主动脉进入腹腔后,与左膈脚毗邻,一般位于左膈脚的正后方,缝合膈肌脚时,从左膈脚进针时一定要注意方向,避免进针过深而损伤主动脉。一旦发生主动脉损伤应快速拔除缝针,然后用纱布压迫此区域5~10分钟,一般都可止血。下腔静脉位于右膈脚右侧,在部分患者可显露,因很少操作到这个区域,所以损伤几率也极低。
2.食管或胃穿孔
食管穿孔多为术者不熟悉贲门区解剖结构,分离食管时解剖层次不清,误伤食管壁造成穿孔。因食管后壁较薄,故较易发生穿孔。胃穿孔最常见的部位在胃底靠近脾上极处,多由于离断胃短血管时超声刀过于靠近胃壁而导致穿孔。还有一种引起穿孔的原因是麻醉师在放置食管探条时动作过于粗暴,术者又未能很好地配合探条通过,导致探条穿透食管或胃壁。穿孔若能在术中及时发现,予间断缝合关闭,多数都能一期愈合。若术中遗漏,或发生迟发性穿孔,就可能造成腹腔或纵隔内感染等严重并发症。若术后出现腹痛、发热等症状,体检有明显腹膜炎体征,要怀疑穿孔可能。可行口服泛影葡胺消化道造影、腹部B超、胸腹平片、CT等进行诊断,小穿孔可通过禁食、胃肠减压和营养支持等保守治疗方法痊愈,若症状明显必须进行手术探查,可行腹腔镜探查及手术,修补穿孔,并行腹腔或纵隔冲洗引流。
3.气胸、皮下气肿和纵隔气肿
在食管裂孔内向上游离食管时,腹腔内的高压气体很容易沿着疏松组织进入纵隔,形成纵隔气肿,再向上则还可到达头颈部形成皮下气肿,此时通过降低腹腔内压力,气肿均能减轻,术后很快自行吸收,无须特殊处理。另外一种情况是损伤胸膜,导致气胸,此时患者的气道压力升高,患侧呼吸音减弱或消失,处理方法是首先减少腹腔内压力至10mmHg以下,其次是通过呼气末正压通气、增加每分通气量等措施改善肺通气,如此多可能保证手术顺利进行,不需要放置胸腔闭式引流。术后随着胸腹腔内CO 2 的排出和吸收,呼吸征象将恢复正常。因为多数此种情况仅有胸膜撕裂而非肺实质损伤,术后肺张力恢复大多没有问题,若术后呼吸仍很急促,应行床旁X线检查,如证实有严重气胸,应放置胸腔闭式引流管。
4.术后吞咽困难
胃底折叠术后短暂的吞咽困难比较常见,多数症状轻微,与术后早期折叠部位水肿等有关,多能在2~6周内自行缓解。如果吞咽困难较严重,明显影响进食或出现胸痛、呕吐等情况,应行吞钡造影,以判断食管下端折叠部位的松紧情况,必要时行胃镜检查。胃镜镜身即能起到一定的扩张作用,多数能缓解梗阻症状。如仍无效,可考虑使用球囊或探条进行扩张。如果症状持续存在,各种非手术方法均无效,则应再次行腹腔镜手术解除梗阻。严重的吞咽困难多数是因为食管裂孔缝合过紧,其次是折叠瓣太大太紧,也有补片移位嵌顿于贲门位置形成狭窄的情况。
为减少术后吞咽困难,多数医生主张术中放置42~60F食管探条(bougie)以扩张食管。一般认为食管探条越粗,预防吞咽困难的效果越好。但放置探条会影响手术操作,并延长手术时间,更有可能导致食管和胃穿孔发生。另一个方法是行术中胃镜以减少术后吞咽困难。我们认为术中充分游离胃底和贲门部,在无张力的情况下进行松而短的胃底折叠,术后吞咽困难将会大大减少。
5.术后折叠瓣移位至纵隔形成食管裂孔疝复发,常见原因有:
①折叠瓣与膈肌固定不充分;②存在短食管而术中未充分游离食管,致使腹段食管有向胸腔内回缩的倾向;③膈肌脚缝合线脱落,裂孔再次裂开。术后3个月内的早期折叠瓣移位建议再次腹腔镜手术治疗,三个月后要根据是否存在症状复发决定是否再次手术,仅有解剖学复发而没有症状者可以先观察,等出现症状后再决定是否二次手术。
6.补片相关并发症
随着近几年合成补片在食管裂孔疝修补术中的应用越来越多,由补片导致的并发症时有发生。补片并发症主要有以下几个方面:①补片侵蚀食管或胃壁造成穿孔;②补片皱缩,变形,对食管造成压迫;③补片与周围组织粘连;④补片移位;⑤补片继发感染。笔者认为放置补片应该注意以下几个方面:①补片缝合固定要确切,防止移位;②补片不要直接跟食管接触,之间应间隔折叠的胃底;③食管和胃底也应该与膈肌脚充分固定,以避免食管上下滑动摩擦补片;④补片材质要柔软,避免将粗糙面与空腔脏器接触;⑤切忌用补片对食管进行环周包绕。我中心曾经接诊一例术后严重吞咽困难的患者,再次腹腔镜探查证实为补片环周包绕严重束缚了食管舒张,在食管上方剪去部分补片后,吞咽困难即刻缓解。笔者认为只要合理选择补片的材质,掌握补片放置的一些原则,补片并发症是完全可以避免的。
7.术后胃肠功能紊乱
症状包括胃肠胀气、嗳气困难、放屁增多、腹泻等,其主要原因为折叠瓣过紧、过大,折叠错位,迷走神经损伤等,有文献报道Nissen手术比Toupet术后胃肠功能紊乱更常见。治疗包括促进胃肠蠕动药物(多潘立酮、马来酸曲美布汀、盐酸伊托必利等)、减少气体进入体内(避免碳酸饮料,细嚼慢咽避免气体咽入)等,术后1年内症状多会慢慢缓解,不主张重新手术,因再次手术可能会带来更严重或新的胃肠功能紊乱问题。
(吴继敏 胡志伟)
参考文献
[1] Katz PO,Gerson LB,Vela MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease[J].Am J Gastroenterol,2013,108(3):308-328.
[2] Wang Z,Hu Z,Wu J,et al. Insult of gastroesophageal reflux on airway:clinical significance of pharyngeal nozzle[J].Front med,2015,9(1):117-122.
[3] El-Serag HB,Sweet S,Winchester CC,et al. Update on the epidemiology of gastro-oesophageal reflux disease:a systematic review[J]. Gut,2014,63(6):871-880.
[4] Goh KL. Gastroesophageal reflux disease in Asia:A historical perspective and present challenges[J]. J Gastroen Hepatol,2011,26(1):2-10.
[5] 潘国宗,许国铭,郭慧平,等.北京上海胃食管反流症状的流行病学调查[J]. 中华消化杂志,1999,1(4):8-11.
[6] Wang R,Yan X,Ma XQ,et al. Burden of gastroesophageal reflux disease in Shanghai,China[J]. Dig liver dis,2009,41(2):110-115.
[7] 汪忠镐,高翔,来运刚,等.咽喷嘴及3S现象:胃食管气道反流的实验研究[J].临床误诊误治,2011,24(3):5-7.
[8] Wang ZG,Wu JM,Liu JJ,et al. Respiratory distress resulting from gastroesophageal reflux is not asthma,but laryngotracheal irritation,spasm,even suffocation[J]. Chin Med Sci J,2009,24(2):130-132.
[9] Wang ZG,Ji F,Wu JM,et al. Effect of laparoscopic fundoplication treatment on gastroesophageal reflux diseaserelated respiratory symptoms[J]. Front Med China,2010,4(2):254-258.
[10] Gao X,Wang ZG,Wu JM,et al. Radiofrequency treatment on respiratory symptoms due to gastroesophageal reflux disease[J]. Chin Med J(Engl),2011,124(7):1006-1009.
[11] 林三仁主编.消化内科学高级教程[M].北京:人民军医出版社,2009:332-334.
[12] Stefanidis D,Hope WW,Kohn GP,et al. Guidelines for surgical treatment of gastroesophageal reflux disease[J].Surg endosc,2010,24(11):2647-2669.
[13] Kohn GP,Price RR,DeMeester SR,et al. Guidelines for the management of hiatal hernia[J]. Surg endosc,2013,27(12):4409-4428.
[14] 吴继敏. 食管裂孔疝诊治中应重视的几个问题[J].临床外科杂志,2013,21(6):419-421.
[15] Horvath KD,Swanstrom LL,Jobe BA. The short esophagus:pathophysiology,incidence,presentation,and treatment in the era of laparoscopic antireflux surgery[J]. Ann Surg,2000,232(5):630-640.
[16] Lugaresi M,Mattioli B,Perrone O,et al. Results of left thoracoscopic Collis gastroplasty with laparoscopic Nissen fundoplication for the surgical treatment of true short oesophagus in gastroesophageal reflux disease and TypeⅢ-Ⅳ hiatal hernia[J]. Eur J cardiothorac surg,2016,49(1):e22-30.
[17] Liang WT,Hu ZW,Wu JM,et al. Mesh-related complications after hiatal hernia repair:two case reports[J]. Gastroenterol Nurs,2015,38(3):226-229.
[18] 胡志伟,汪忠镐,吴继敏,等.胃食管反流病合并食管裂孔疝及哮喘症状的腹腔镜外科治疗[J].中华疝和腹壁外科杂志(电子版),2014,8(5):396-402.


