第十章
腹腔镜脾切除并贲门周围血管离断术
门静脉高压症的外科治疗目的是治疗其并发症,包括继发性脾功能亢进和上消化道出血,传统的外科治疗方式包括断流术和分流术,各有优缺点。作为我国门静脉高压症外科治疗特色之一的断流术,其传统手术方式创伤大、肝功能损害重且并发症较多,而随着腹腔镜手术的成熟和一些特殊器械(如超声刀、Ligasure血管闭合系统、切割闭合器等)的使用,腹腔镜微创技术为治疗肝硬化门静脉高压症提供了一种新的选择。
【适应证】
1.肝硬化门脉高压患者,肝功能Child分级A级或B级,既往有上消化道出血史;
2.食管中、下段有中度以上静脉曲张,有呕血史,或有食管下段静脉曲张破裂造成难以控制大出血的可能,脾脏增大伴脾功能亢进;
3.无严重腹水和明显黄疸,或经内科治疗上述症状好转。
【禁忌证】
1.脾周围炎、脾静脉炎较重或脾静脉血栓形成;
2.脾功能亢进伴食管、胃底静脉曲张严重,出血正在发生;
3.肝功能Child C级;
4.有上腹部手术史,存在严重粘连者;
5.其他腹腔镜手术常规禁忌证。
【术式选择】
目前在临床上开展较多的术式包括 完全腹腔镜脾切除加贲门周围血管离断术(complete laparoscopic splenectomy plus pericardial devascularization, LSPD)、手助腹腔镜脾切除加贲门周围血管离断术(handassisted laparoscopic splenectomy plus pericardial devascularization, HLSPD)以及 改良手助腹腔镜脾切除加贲门周围血管离断术(modified hand-assisted laparoscopic splenectomy plus pericardial devascularization,MHLSPD)。三者目标一致,都是以微创的手术方式切除脾脏并对贲门周围血管进行离断,从而达到断流的目的,只是术中所用器械及具体操作方式有所差异。LSPD与HLSPD的区别在于,后者需要术者经手助装置将非优势手伸入腹腔协助操作,而MLSPD则是先在手辅助下完成腹腔镜下巨脾切除,然后转为完全腹腔镜下行贲门周围血管离断。
对初期开展腹腔镜脾切除加贲门周围血管离断术的团队,以及对经CT评估脾脏容积≥600ml,Child-Pugh评分≥9,或有大的脾周侧支血管形成的患者,建议使用HLSPD,因为此术式中,术者可以接触腹腔脏器,精确判断组织的质地、方位和毗邻关系,使镜下操作更加准确;同时用手协助进行牵引和显露,便于控制术中意外出血,降低了手术风险和难度,尤其对于较大脾脏其优势更加明显;另外也有助于缩短此类腹腔镜手术的学习曲线。而MHLSPD则兼具HLSPD和LSPD的优势,手辅助腹腔镜巨大脾脏切除较全腹腔镜下更为安全,可以用腹腔镜切割闭合器切断脾蒂,避免了全腹腔镜下巨脾切除时游离脾蒂的困难;在全腹腔镜下行贲门周围血管离断时,手术视野暴露充分,避免了在离断贲门右侧血管时,肝脏左叶、器械和左手在腹腔内的相互干扰;将脾脏装入标本袋中经手助器取出,缩短了取脾时间,且消除了标本袋破裂导致脾种植的可能。该术式安全性好,操作方便,术中出血少,值得临床推广。
【术前准备】
术前积极护肝治疗,纠正低蛋白血症至血白蛋白30g/L以上,消除腹水,静脉滴注极化液葡萄糖、胰岛素、氯化钾和维生素,术前间断输注血浆、冷沉淀等纠正凝血功能异常。术前流质饮食和清洁灌肠,以减少胃扩张。术前常规留置胃管、尿管。
【麻醉】
气管插管全身麻醉。
【体位与套管放置】
患者平卧位,右倾30°~45°,头高30°,术者及扶镜手均位于患者右侧,术者在头侧,助手在足侧。助手根据需要位于患者左侧或右侧(术者左侧),监视器分别置于术者及助手对面(图10-1)。LSPD在脐下缘放置10mm套管作为观察孔(A),左腋前线肋缘下2cm处放置12mm套管为主操作孔(C),剑突左侧肋缘下2cm处(B)及剑突右侧肋缘下2cm处(D)各放置5mm套管为辅助操作孔。后期将C孔扩大成5~6cm切口,作为取标本口,并从该处放置腹腔引流管。HLSPD和MHLSPD取消D孔,而增加一7cm纵向切口用于放置手助器,根据情况该切口可位于右上腹或正中线(图10-2)。
【手术器械】
常规腹腔镜手术器械、超声刀、Ligasure血管闭合系统、直线切割闭合器,此外HLSPD和MHLSPD还需要手助器。国内最初常用“蓝碟”手助器,现在改进的“新蓝碟”手助器采用两件式组合,使用更方便,配合辅助手的指套式器械,可以减少更换器械次数,完成更多复杂精细的操作,缩短手术时间。
【手术相关解剖】
脾蒂血管的处理是本手术的关键步骤之一。脾动静脉在接近脾门时互相靠拢,动脉在前,静脉在后,经脾门出入脾脏,称为脾蒂。脾动脉主干在脾门分为终末支后进入脾脏,即脾叶动脉,分出终末支前的脾蒂为一级脾蒂。脾动脉分支呈集中型和分散型两种(图10-3),集中型占30%,脾动脉在距脾门0.6~2.0cm处分成两大支,即脾上、下极终末支,分别支配脾脏的上半部和下半部,此两支称为二级脾蒂,它们又各自分出3~5支最后支至脾脏的上下极,脾最下极支细长,在分离脾结肠韧带前常需先离断,以免撕脱,此类型脾动脉主干较长而终末支较短。分散型占70%,脾动脉在距脾门2.1~6.0cm处分成脾上、下极动脉和脾上、下极终末动脉,此四大分支称为二级脾蒂,此类型脾动脉主干较短而二级脾蒂较长。脾静脉及分支与动脉伴行。
【手术步骤】
一、LSPD
以穿刺法或开放法放置观察套管及建立气腹,置入腹腔镜探查有无多量腹水,观察肝脏大小、质地、表面情况,脾脏大小及脾周有无粘连和程度,观察食管下段和贲门周围血管曲张情况(图10-4),注意勿损伤脾脏。根据脾脏大小放置左腋前线肋缘下12mm套管,剑突左侧肋缘下5mm套管,剑突右侧肋缘下5mm套管,调整套管位置,需满足贲门及脾门两个主要操作位置之间的转换(图10-5)。
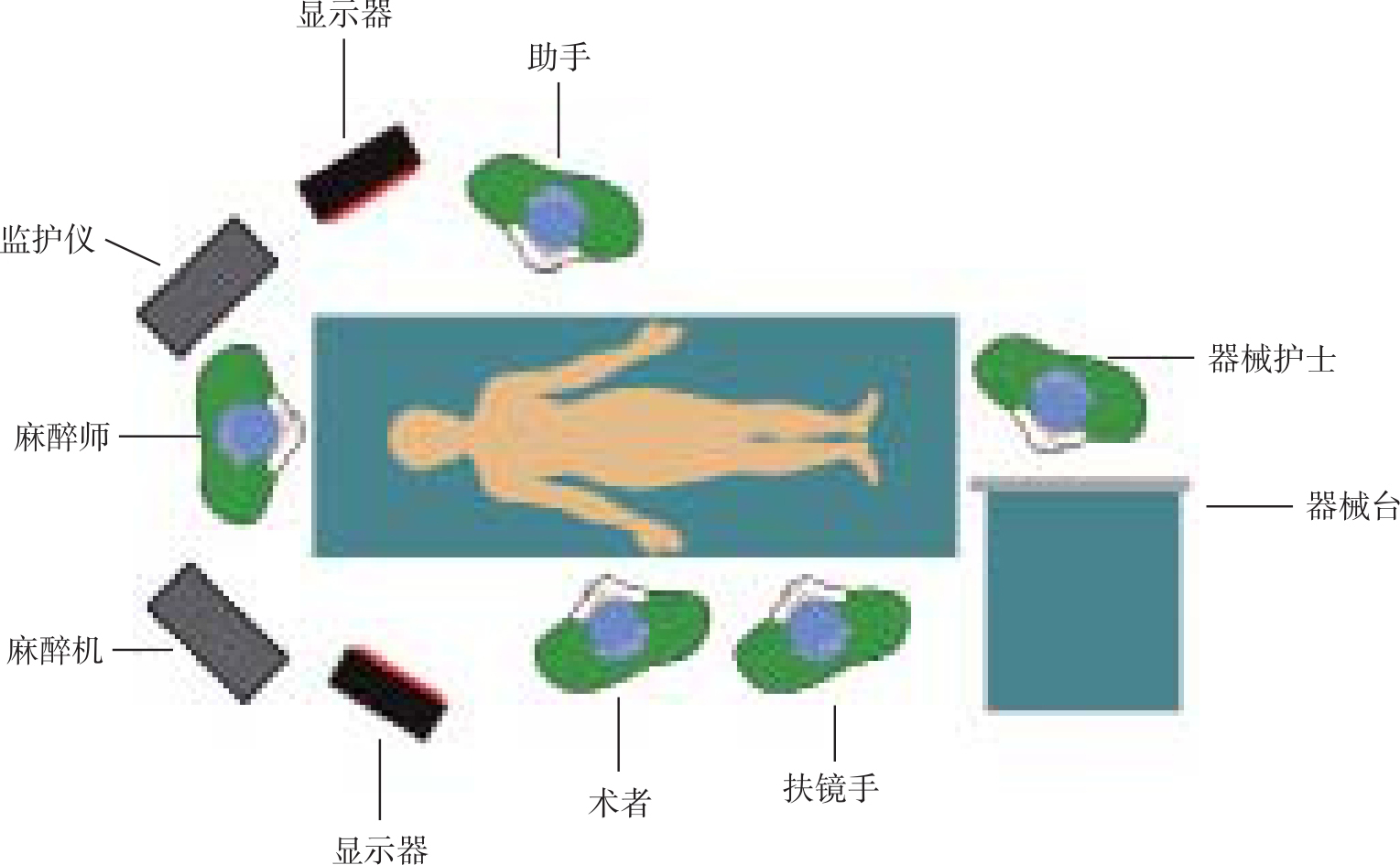
图10-1 手术室布局
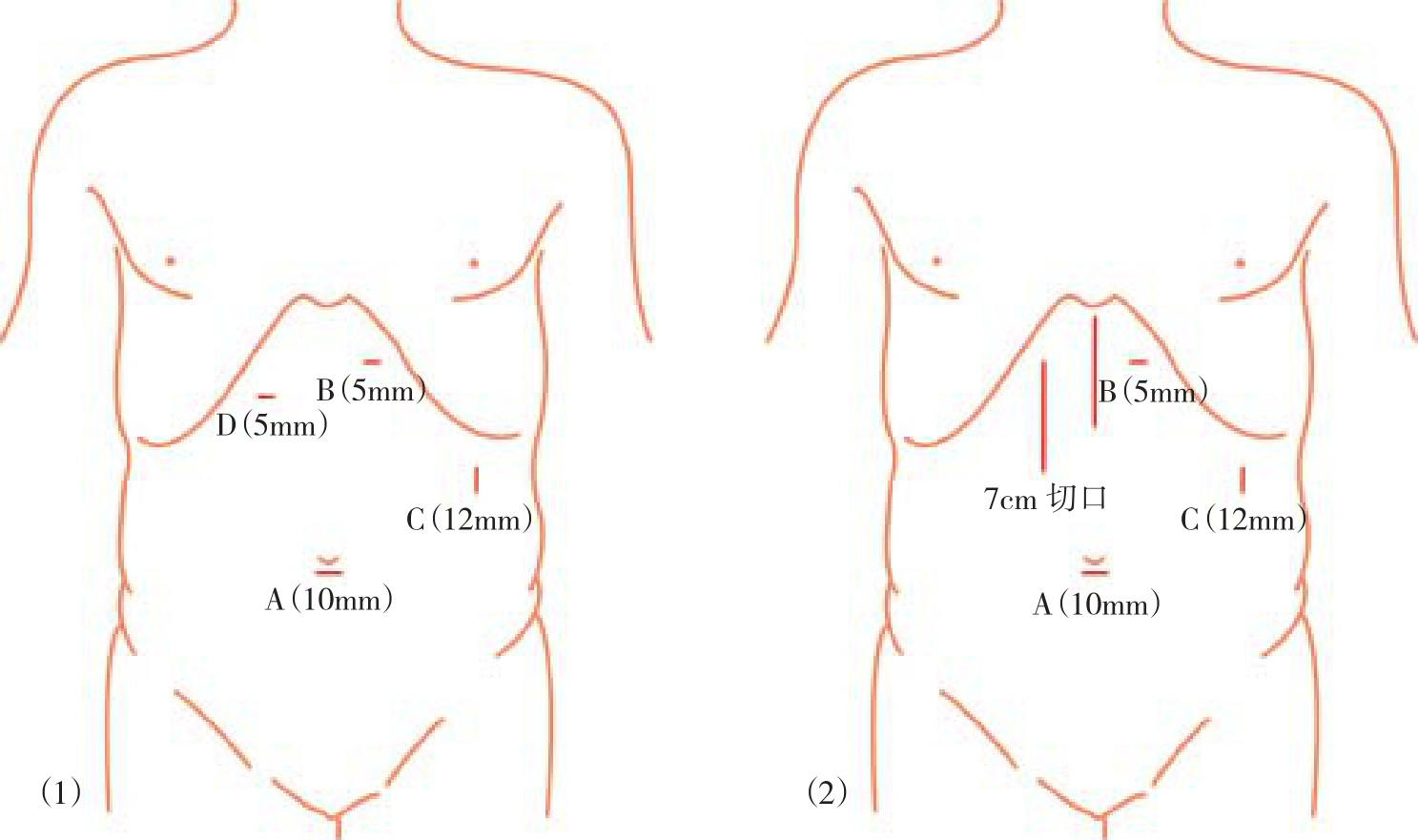
图10-2 套管放置示意图
(1)LSPD套管位置;(2)HLSPD和MHLSPD套管位置
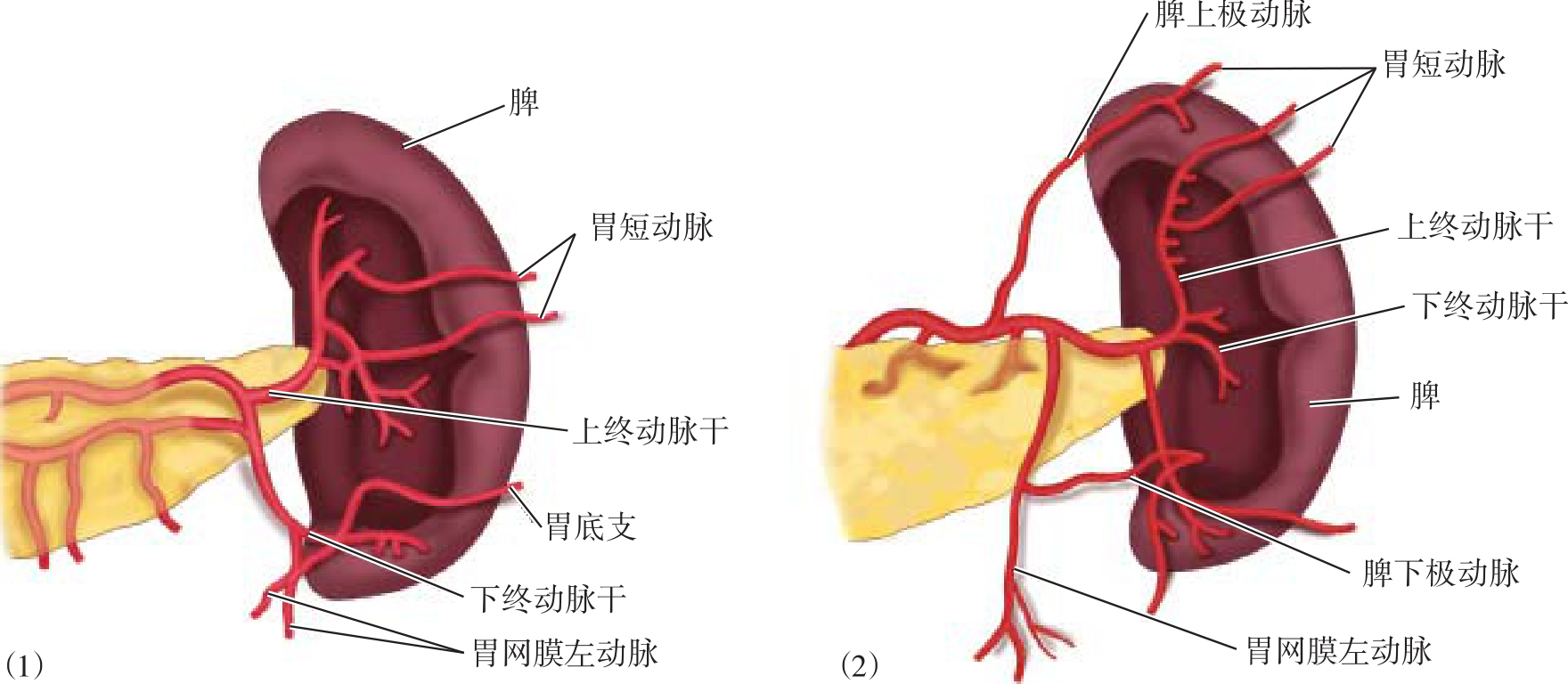
图10-3 脾动脉解剖
图10-4 全面探查腹腔、肝脏、脾脏及贲门周围
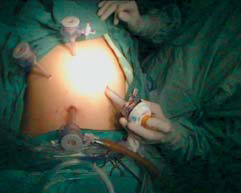
图10-5 根据腹腔情况选择套管位置
超声刀或Ligasure血管闭合系统自幽门下方向胃近端离断胃结肠韧带、脾胃韧带和胃后方的胃短血管(图10-6)。在离断过程中遇到明显曲张的血管,夹闭后再离断。在胰体尾上缘分离脾动脉主干,用可吸收夹闭合,不必离断(图10-7)。从脾脏下极开始,用超声刀分离脾周粘连、脾结肠韧带、脾胃韧带中下部及脾肾韧带,显露脾蒂(图10-8)。将脾下极抬起,在脾门处自下而上逐支分离脾蒂血管分支,用可吸收夹或钛夹闭合后离断(图10-9)。若遇到较粗的脾蒂血管分支,尤其是静脉分支,可用丝线或可吸收线结扎,再在结扎线两端夹闭血管后离断(图10-10)。如此逐渐向脾上级分离。最后处理胃脾韧带上部及脾膈韧带,切除脾脏(图10-11)。也可先完全游离脾周韧带后使用直线切割闭合器离断脾蒂(图10-12)。
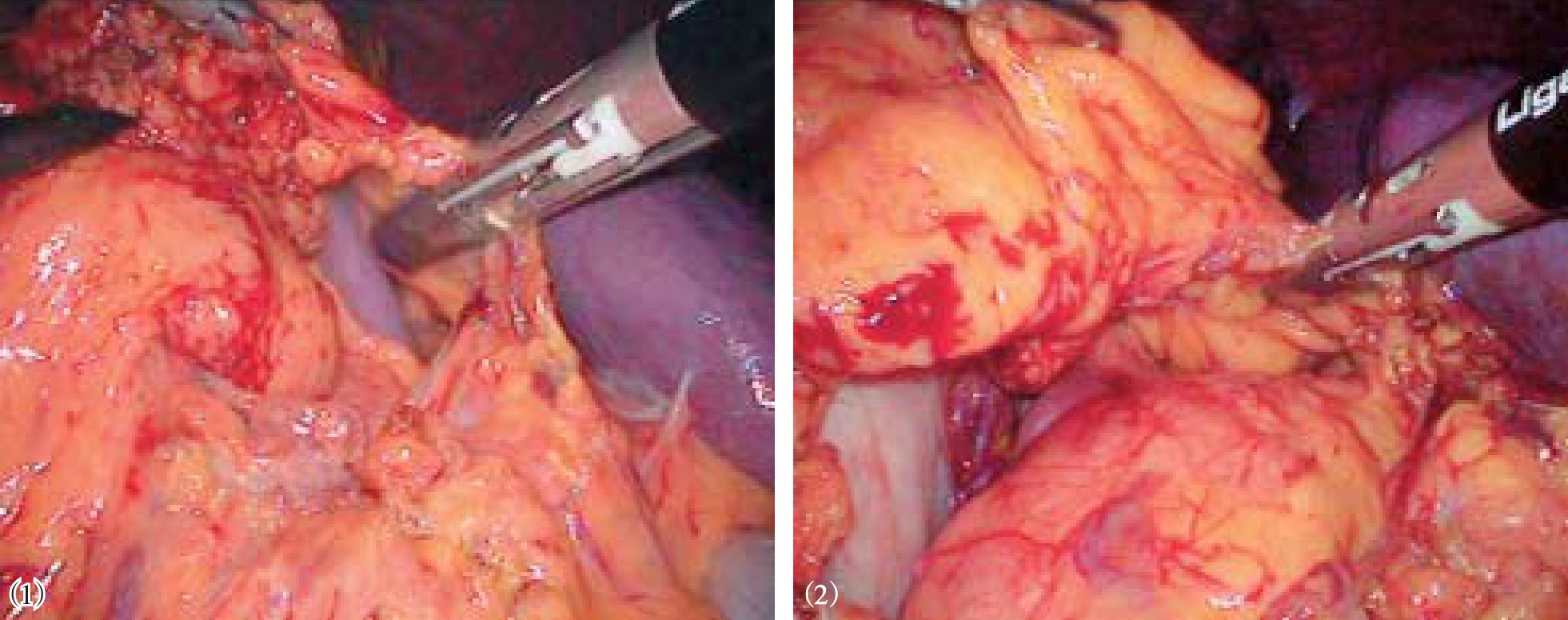
图10-6 离断胃结肠韧带、脾胃韧带
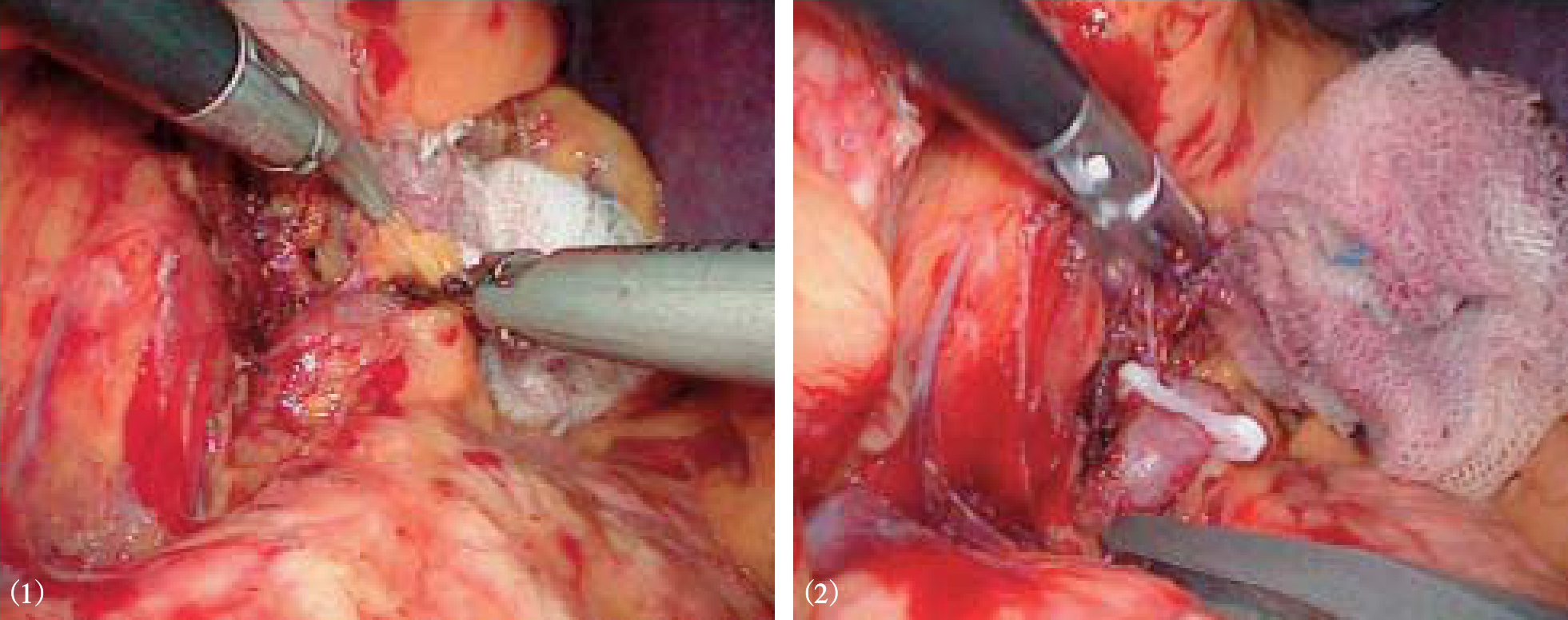
图10-7 在胰体尾上缘分离脾动脉主干

紧靠胃壁和贲门,用超声刀或Ligasure血管闭合系统离断胃底后壁周围的曲张血管至贲门,离断胃底与左膈肌脚之间的组织和曲张血管(图10-13)。沿胃大弯继续向上游离胃底直至贲门左缘(图10-14)。然后将胃向上掀起,于胃后方进行胃小弯的操作,解剖胃胰襞,结扎后离断胃左血管,或直接使用直线切割闭合器离断胃左血管(图10-15)。分离肝胃韧带,沿胃小弯向上游离,离断食管支(图10-16)。在进行贲门周围及食管下段去血管化时,尤其在右侧必须紧贴贲门及食管壁操作,注意保护食管旁静脉丛。再打开贲门前方浆膜,沿食管向上游离6~8cm,离断高位食管支及食管周围可见的曲张静脉(图10-17)。在完成胃底、贲门和食管下段周围血管离断后,取出脾脏,脾窝放置引流管(图10-18)。
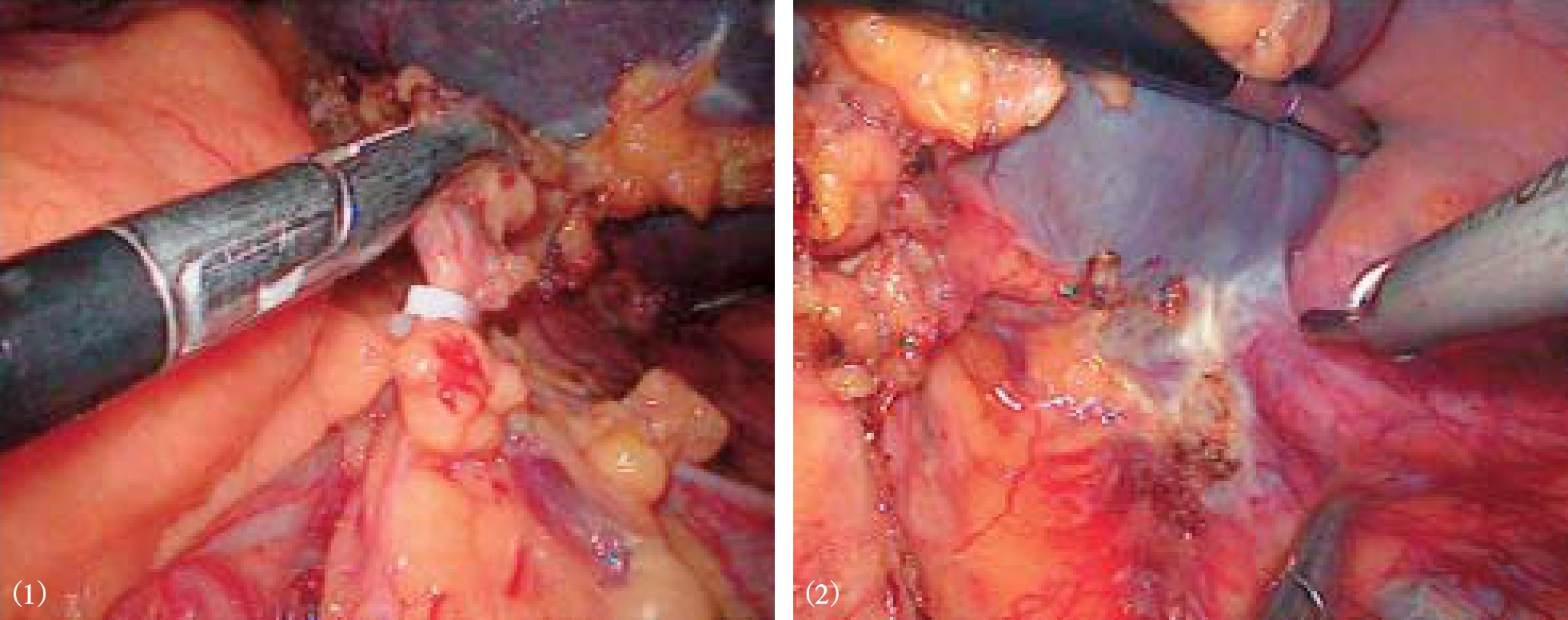
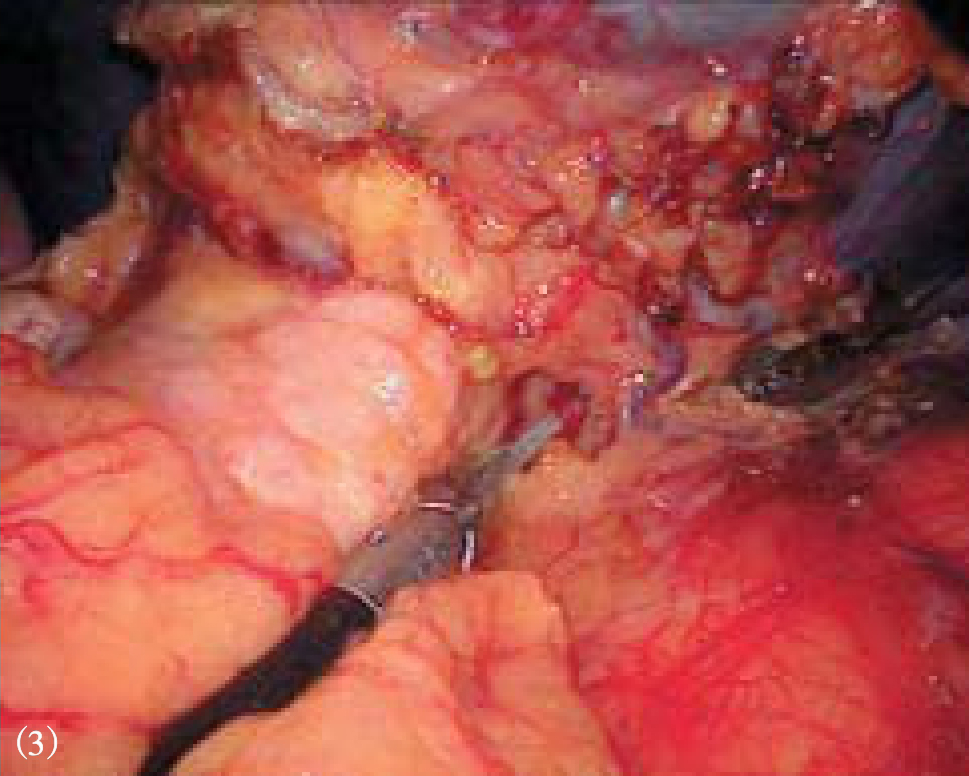
图10-8 分离脾下极脾周粘连、脾结肠韧

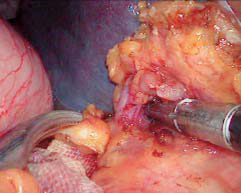
图10-9 脾门处自下而上逐支分离脾蒂血管分支
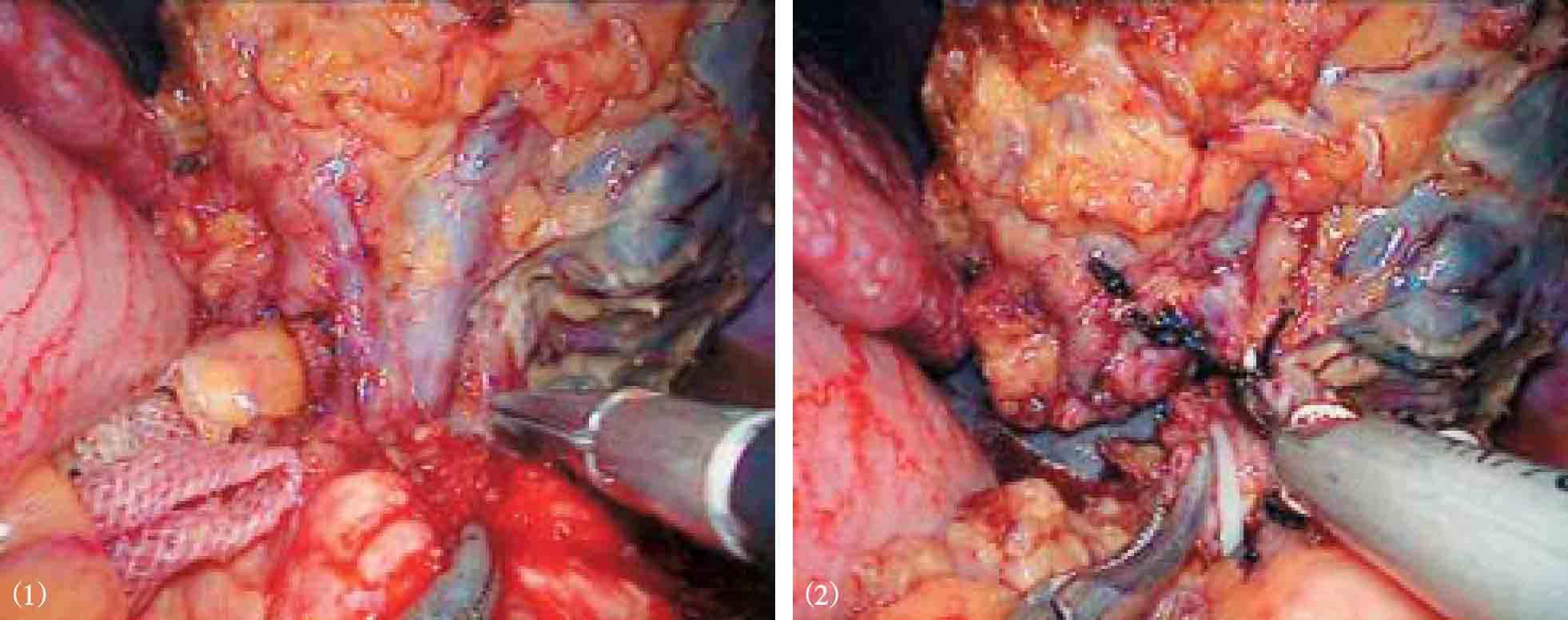
图10-10 较粗的静脉分支,可用丝线结

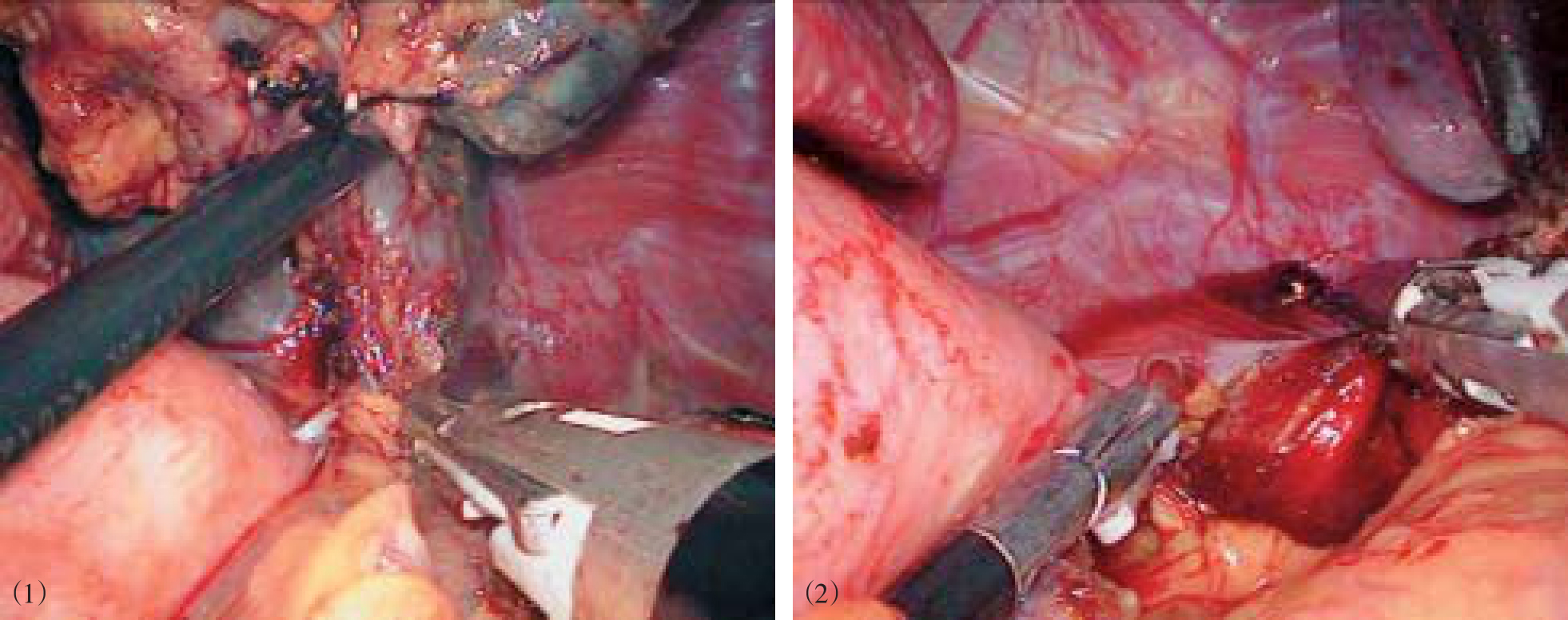
图10-11 处理胃脾韧带上部及脾膈韧带
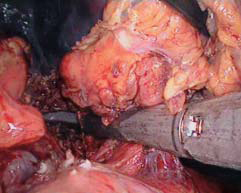
图10-12 直线切割闭合器离断脾蒂
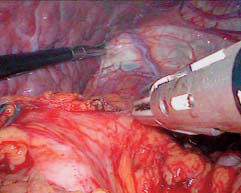
图10-13 离断胃底与左膈肌脚之间的组

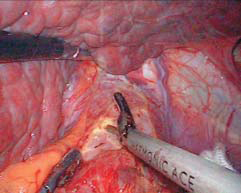
图10-14 游离胃底直至贲门左缘
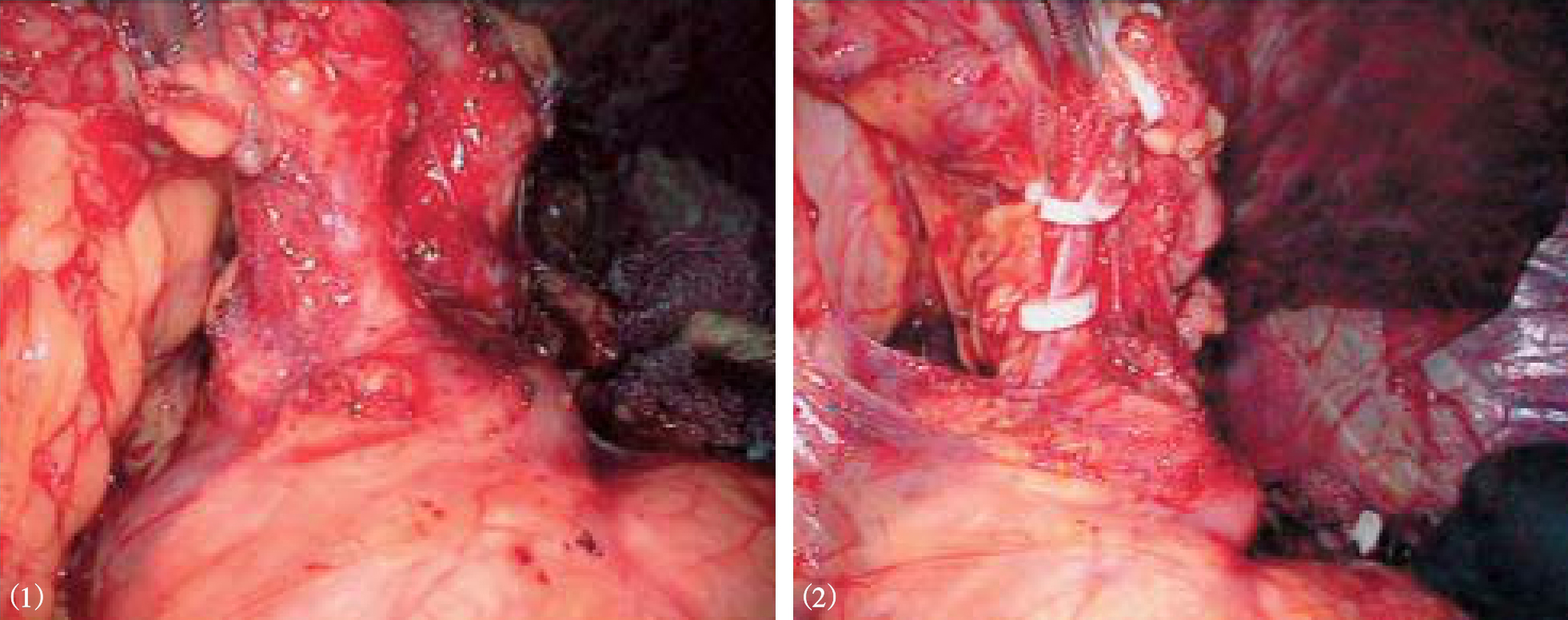
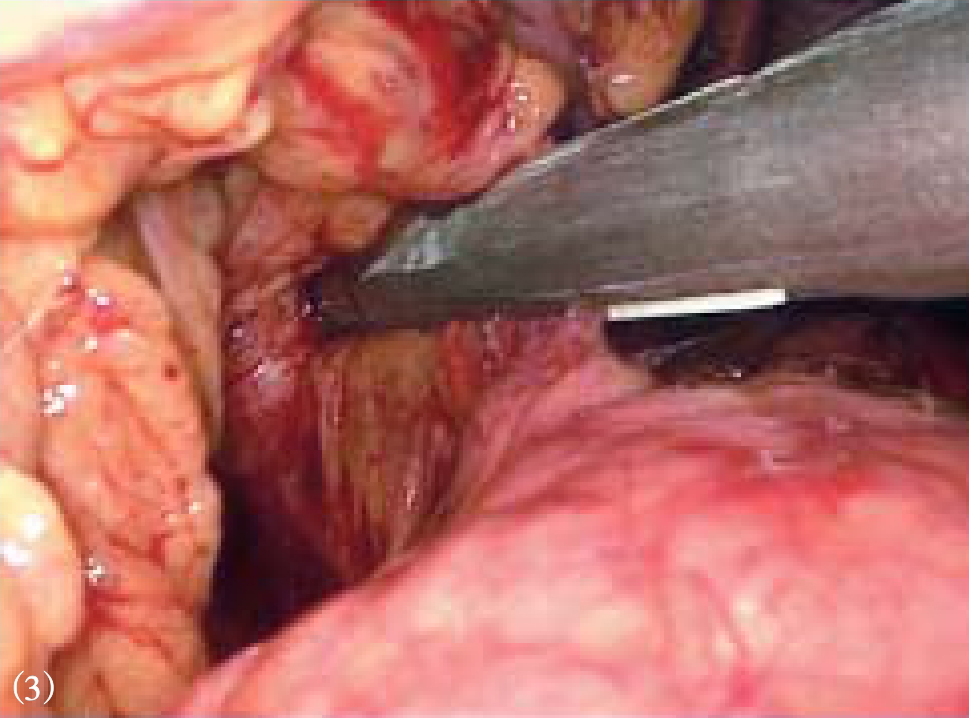
图10-15 解剖胃胰襞,血管夹或切割缝

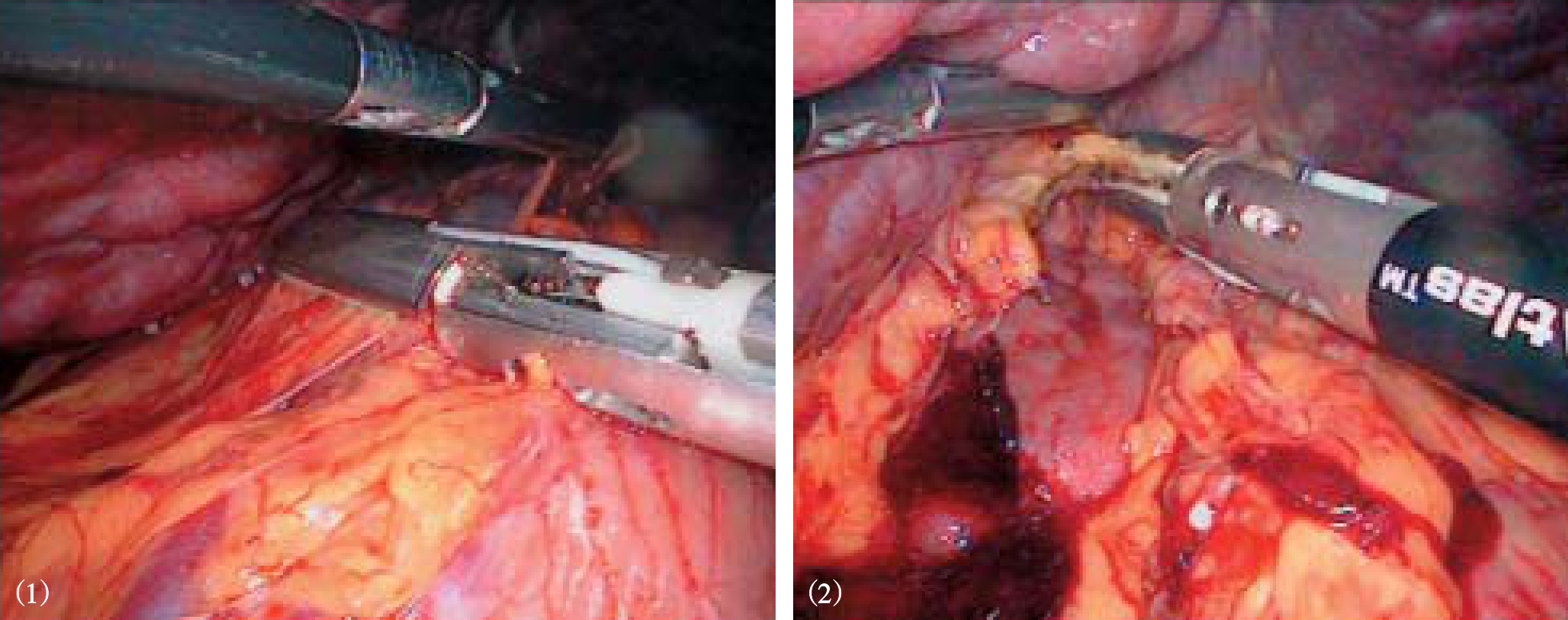
图10-16 分离肝胃韧带,沿胃小弯向上

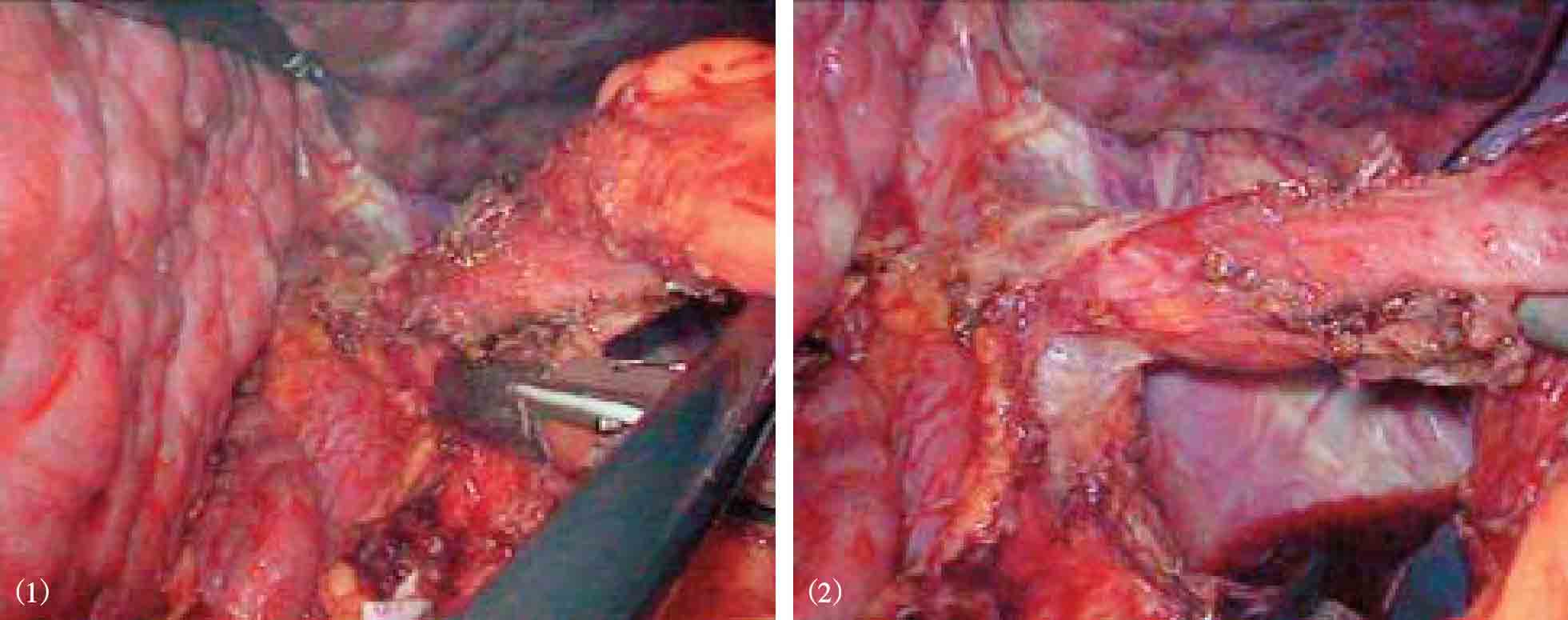
图10-17 沿食管再向上游离6~

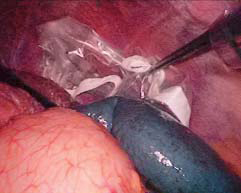
图10-18 将脾脏装入标本袋
二、HLSPD
在脐上缘放置观察套管,建立气腹并行腹腔探查后,根据脾脏大小放置左腋前线肋缘下12mm套管,剑突左侧肋缘下5mm套管,视情况在右上腹或正中线做一7cm纵向切口,放置手助器(图10-19)。术者左手(非优势手)入腹,重新建立气腹后用超声刀或Ligasure血管闭合系统自幽门下方向胃近端离断胃结肠韧带、脾胃韧带和胃大弯后方的血管(图10-20)。遇到明显曲张的血管时,夹闭后再离断。在胰体尾上缘分离脾动脉主干,血管夹夹闭(图10-21)。从脾脏下极开始,用超声刀分离脾周粘连、脾结肠韧带及脾肾韧带,显露脾蒂。切开胰尾上缘的后腹膜,以左手手指分离胰尾及脾蒂,将脾蒂控制在手中,用直线切割闭合器(白色钉仓)切断脾蒂(图10-22)。继续游离脾肾韧带和脾膈韧带,完整切除脾脏(图10-23),装入标本袋中,经手助器取出(图10-24)。用手控制胃,离断胃底与左膈肌脚之间的组织和曲张血管,至贲门左缘(图10-25)。打开胃胰皱襞,显露、离断胃左血管(图10-26)。沿胃小弯分离肝胃韧带,离断食管支(图10-27)。沿食管再向上游离6~8cm,离断高位食管支及食管周围可见的曲张静脉(图10-28)。必要时先用可吸收血管夹夹闭,再离断血管。游离过程中可用手分辨胃壁和食管肌层的界限,防止损伤。断流完成后,检查无出血,脾窝放置引流管。
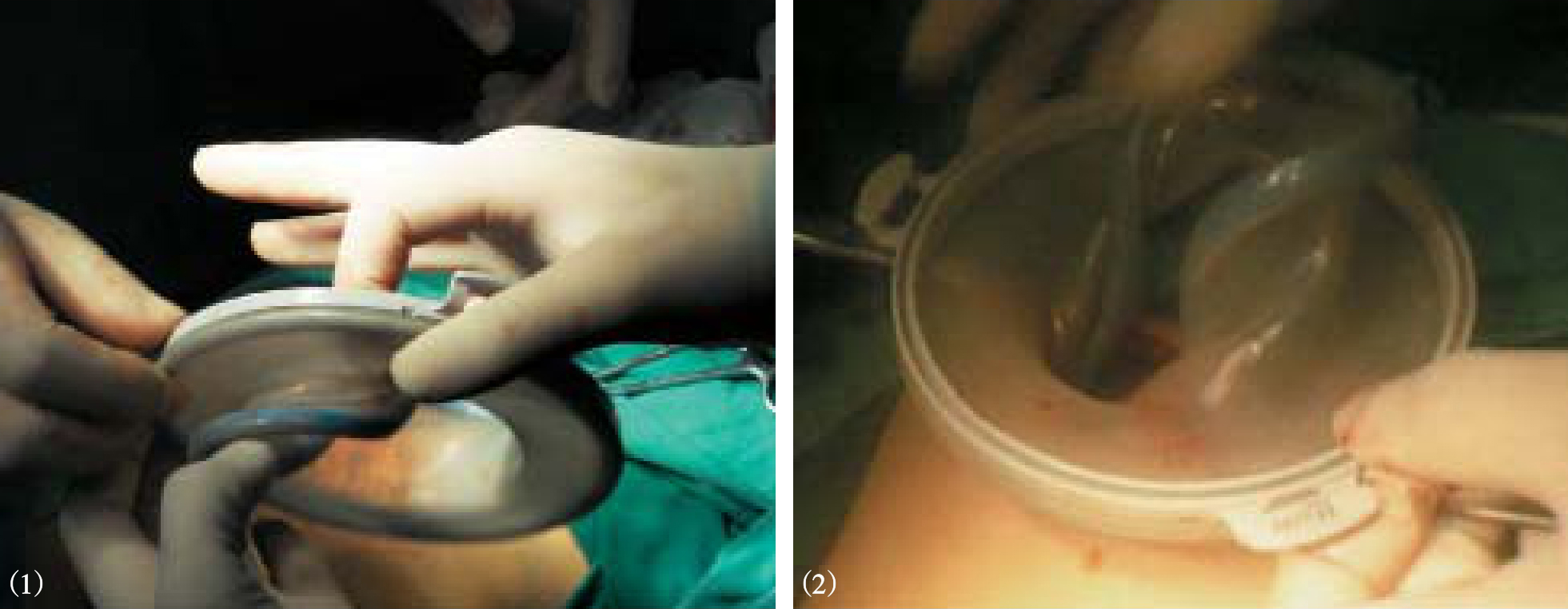
图10-19 手助器的放置
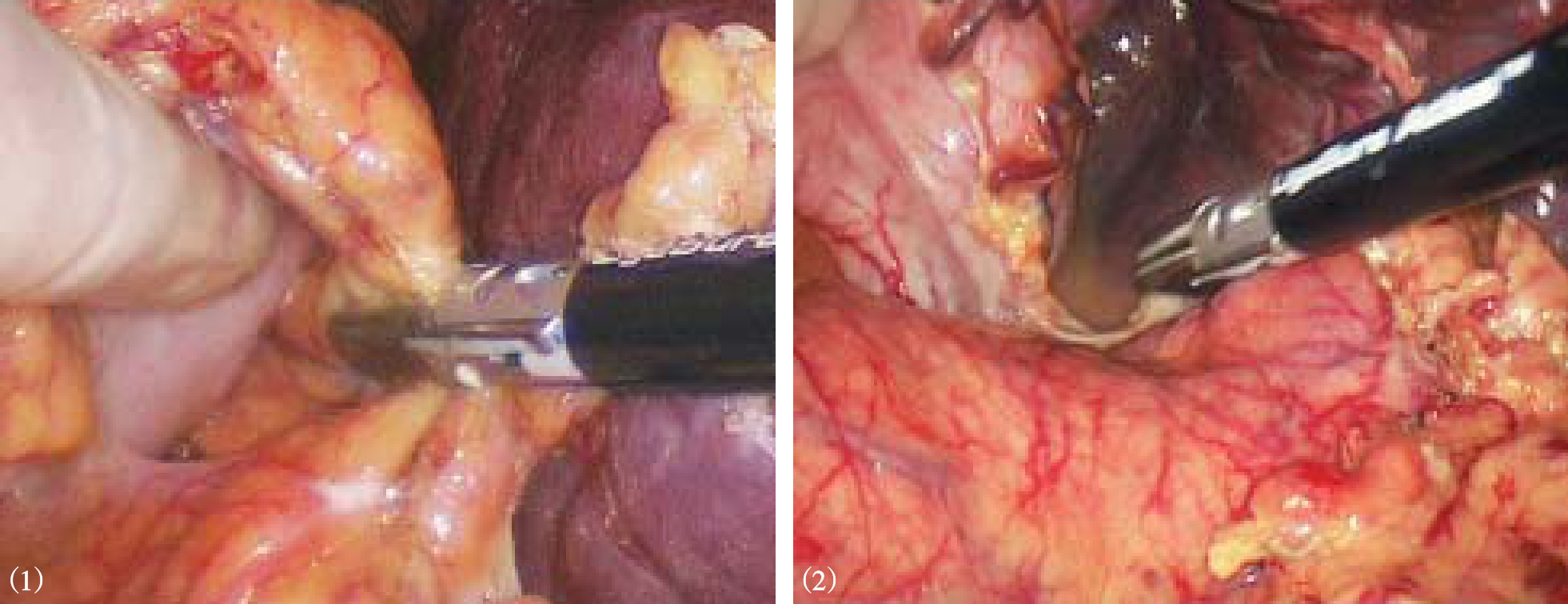
图10-20 幽门下方向胃近端离断胃结肠

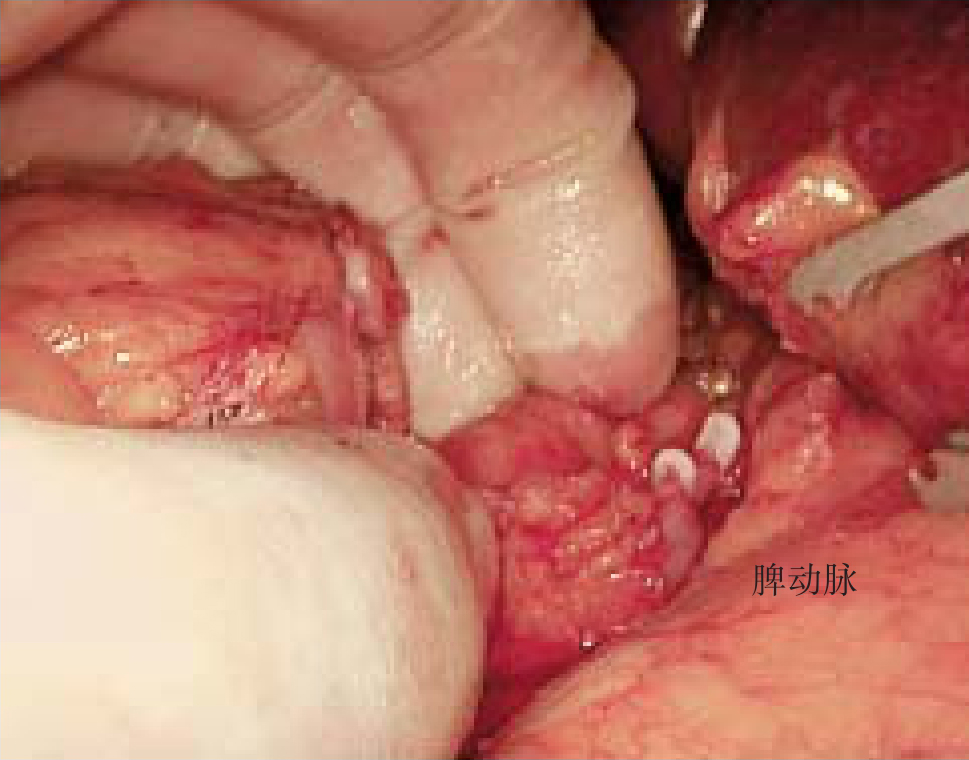
图10-21 在胰体尾上缘分离夹闭脾动脉主干
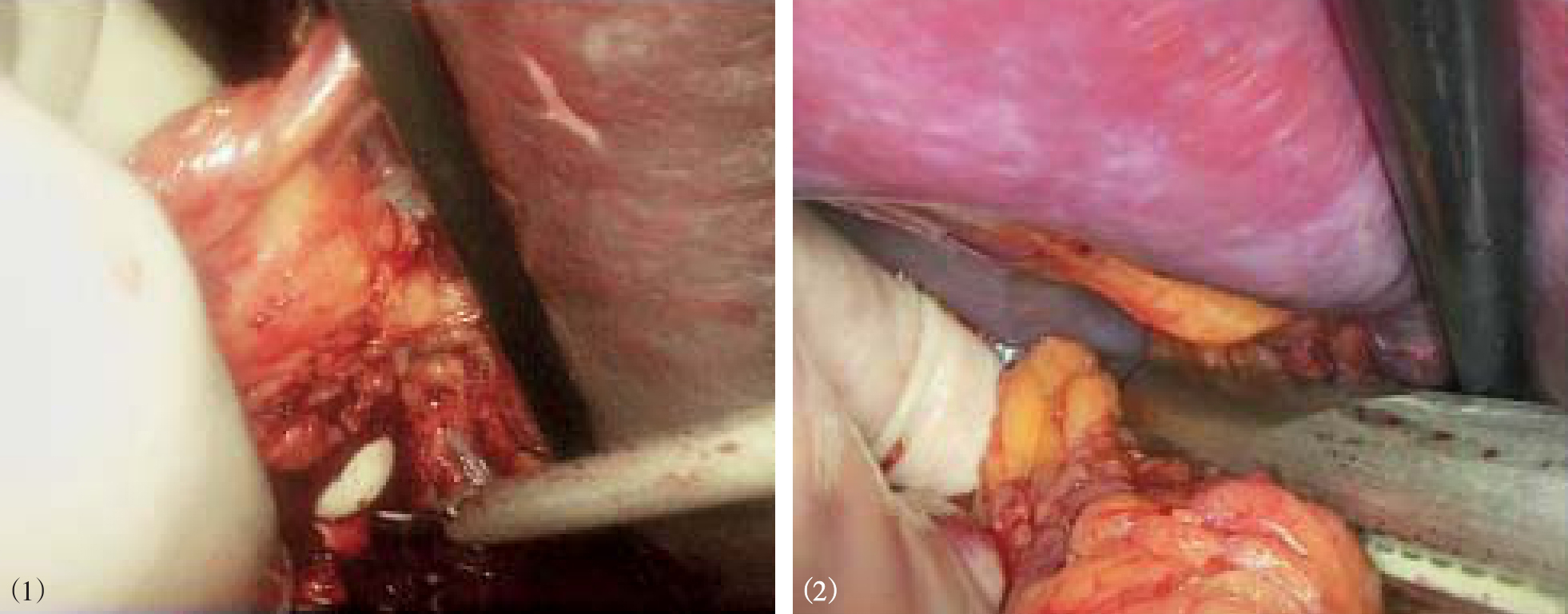
图10-22 直线切割闭合器离断脾蒂
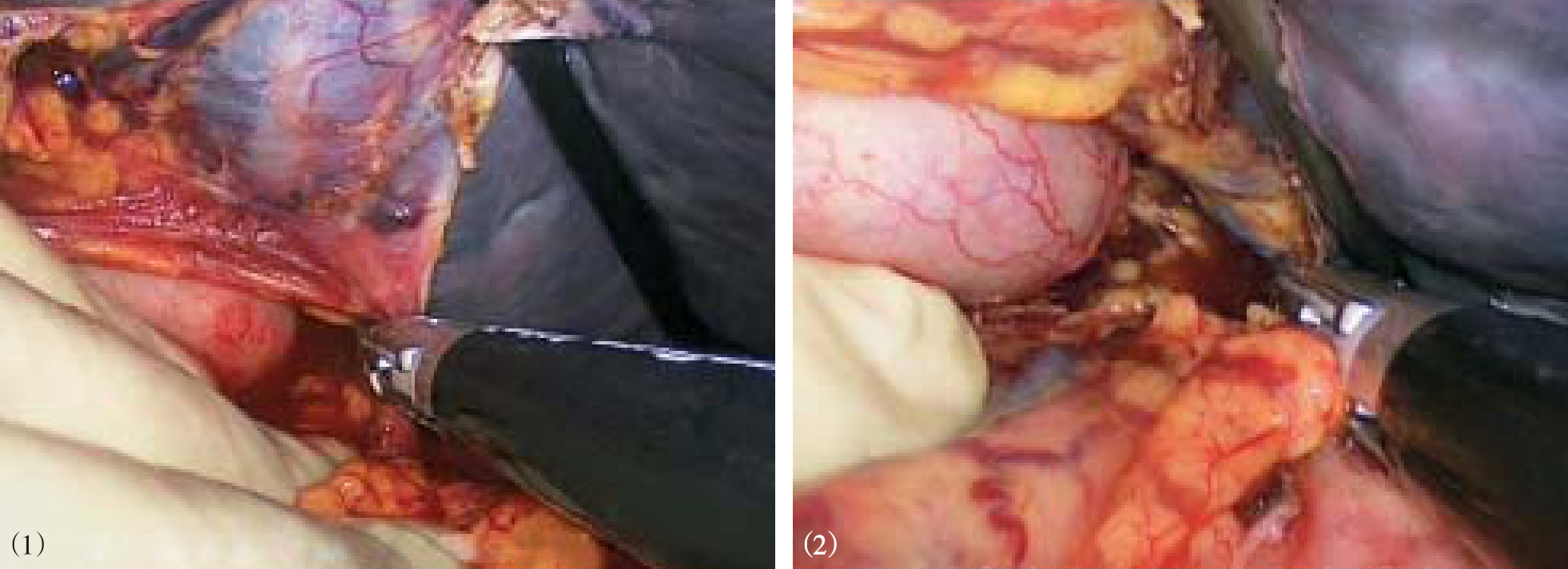
图10-23 游离脾肾韧带和脾膈韧带,完

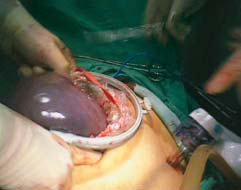
图10-24 脾脏装袋,经手助器取出
图10-25 离断胃底与左膈肌脚之间的组

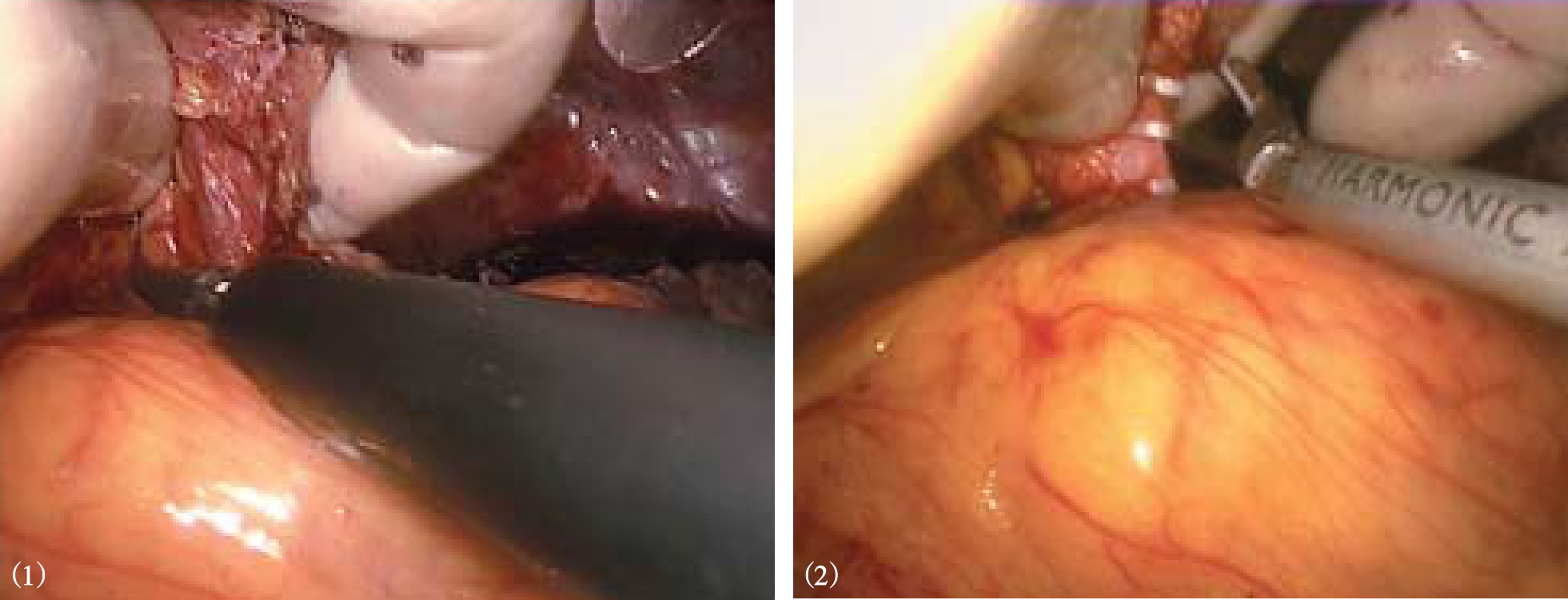
图10-26 显露、离断胃左血管
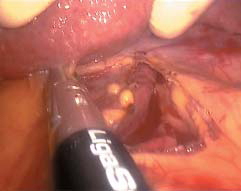
图10-27 分离肝胃韧带,离断食管支
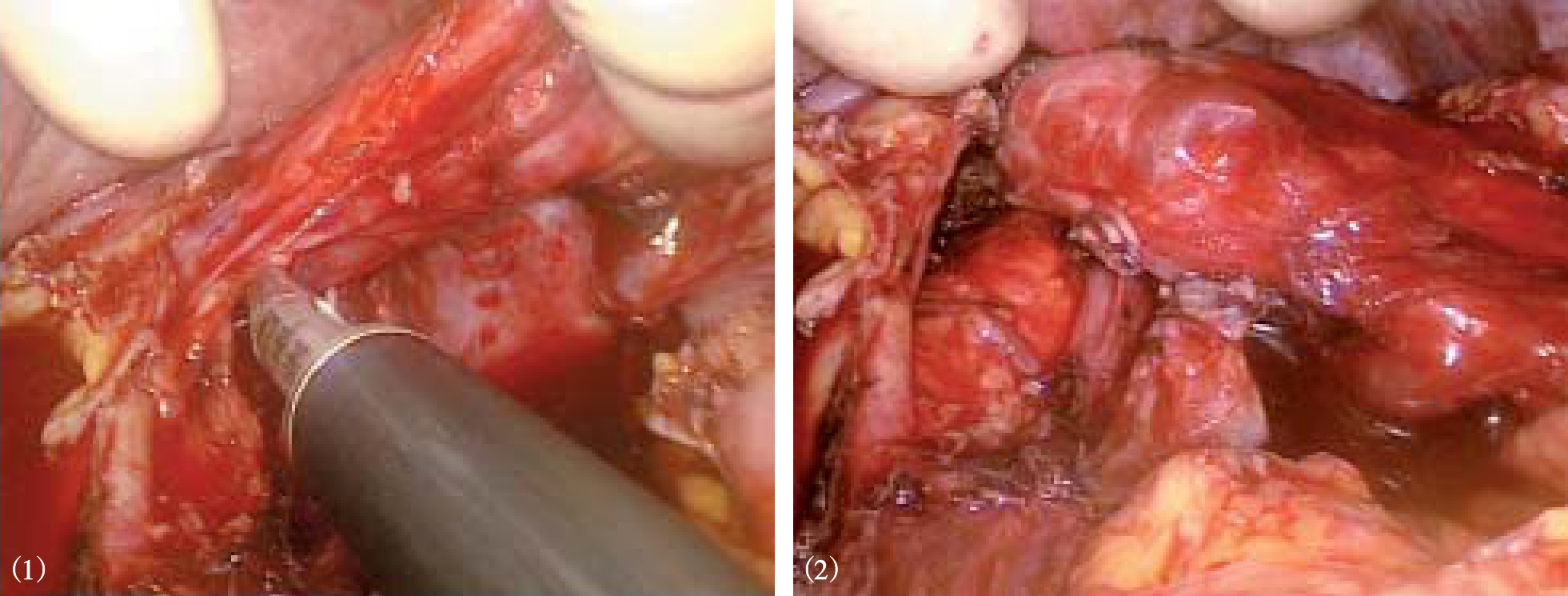
图10-28 离断食管周围可见的曲张静脉
三、MHLSPD
我们对HLSPD进行了一些改进,以扬长避短,充分发挥手助腹腔镜和完全腹腔镜手术的优势,也取得了良好的临床效果。该术式首先在手辅助下完成腹腔镜下巨脾切除术,然后在手助器中置入5mm套管并闭紧(图10-29),转为完全腹腔镜下行贲门周围血管离断。手术步骤同完全腹腔镜及手助术式中的相关部分。
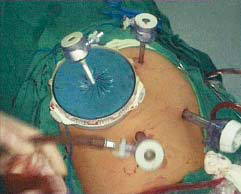
图10-29 关闭手助器,转为完全腹腔镜下操作
【要点分析】
腹腔镜贲门周围血管离断术是在腹腔镜脾切除术的基础上发展而来,由于肝硬化门静脉高压症患者脾脏巨大,手术暴露困难,血管曲张明显,常常合并凝血功能障碍,稍有不慎极易发生大出血,而且贲门周围血管离断技术要求较高,故需要术者有丰富的腹腔镜手术经验,设备齐全,并有良好的团队合作。
1.操作顺序
先进行脾脏的游离和切除,再进行贲门周围血管离断。游离脾脏可先分离脾下极及其背后侧的脾结肠韧带和脾肾韧带,再分离脾胃韧带下半部,离断脾蒂,最后游离剩余的脾胃韧带和脾膈韧带。行贲门周围血管离断时,可在切脾结束后沿胃大弯继续向上游离胃底,直至贲门左缘。而后将胃向上掀起,于胃后方进行胃小弯的操作。先解剖胃胰襞,离断胃左血管,再沿胃小弯向上游离至胃裸区,离断食管支,再打开贲门前方浆膜,沿食管向上游离6~8cm,离断高位食管支及食管周围可见的曲张静脉。
2.辅助器位置的选择
手助和改良手助腹腔镜脾切除加贲门周围血管离断术中一般先建立观察孔,置入腹腔镜探查。确认肝硬化情况、脾脏大小及周围粘连程度,根据情况决定切口在右上腹或正中线,如脾脏巨大,将辅助器置于右上腹更利于操作。
3.脾动脉和脾蒂的处理
在处理脾蒂以前,先打开胃结肠韧带及部分脾胃韧带,在胰体尾上缘观察脾动脉搏动,确认后打开动脉下缘腹膜,游离血管后上方,用可吸收夹夹闭或用丝线结扎,不必离断,可缩小脾脏,便于后续操作。结扎脾动脉应尽量靠近胰尾,以避免在脾动脉分出胰大动脉前结扎,引起胰腺缺血性损伤(导致胰腺炎)。如果在胰腺上缘未发现脾动脉,则打开胰尾上下缘的被膜,从下方小心游离胰尾背面并向右上方翻起,发现脾动脉后结扎。如翻起胰尾后仍未发现脾动脉,则可能是走行在胰腺内或起源及走行变异,不必再强求结扎。
完全腹腔镜下切除巨脾时,由于脾脏巨大,质硬脆,术中不易托起脾蒂,而且由于静脉曲张,脾蒂常较宽,难以在腹腔内用直线切割闭合器闭合。可采用次级脾蒂离断法,即在脾门逐支分离出脾上下极动静脉分支,分别结扎切断。有时脾脏与胰尾形成紧密粘连,分离时需注意防止损伤胰尾。脾蒂不宽时可在腹腔内用直线切割闭合器离断,但要先完全游离脾周围韧带,其中脾上极的游离会比较困难,需要术者对其预先估计,灵活处理。
在手助腹腔镜下,可采用与完全腹腔镜下手术相同的策略离断脾蒂,此时对脾脏上极的游离相对容易,术者可以用手将脾上极托起,用超声刀或Ligasure进行充分的游离,将脾蒂控制在手中。也可以先切断脾蒂,即在脾胃韧带离断后,用手指在脾蒂后方轻轻钝性分离到达脾蒂下方,从脾蒂后方穿出后并将其控制,从左肋缘下套管置入直线切割闭合器,在手指引导下将闭合器钉座穿过脾蒂后方,夹闭并切断脾蒂,然后再游离脾周围韧带。
4.胃左血管的处理
采用右倾头高体位。在脾脏切除后,胃大弯大部已经游离,使胃后及左膈下的血管很容易显露。大弯游离后可以容易地将胃向上掀起,并在胃后方显露胃左血管。在胃左血管根部进行解剖可减少手术时间。这种入路比从前面打开肝胃韧带再离断胃左血管容易操作,在处理食管支和高位食管支时,也有较好的视野。当胃左血管迂曲成团,分离困难时,可采用腹腔镜下直线切割闭合器离断胃左血管。若操作困难或分离出血,可改用手助方式。
5.贲门周围血管离断
腹腔镜下进行贲门周围血管离断时,应利用腹腔镜的放大作用,仔细分离和结扎胃左动静脉及其以上所有曲张静脉,特别是高位食管支和左膈下静脉(图10-30)。有时因显露困难处理不全,成为术后再出血的原因。在解剖、离断高位食管支时,应沿贲门右侧食管下段右后方上行,最好分离至贲门上6~8cm,这样不会遗漏少数位置深且隐蔽的异位高位食管支。左膈下静脉可单支或分支进入食管下段左侧肌层,也应确切处理。切忌用超声刀直接离断较粗的曲张静脉,尤其是膈下静脉,会引起大出血。Ligasure可安全闭合7mm以下动静脉,闭合带可承受三倍人体动脉压,因此可安全离断脾蒂二级血管和胃周曲张血管。
而与完全腹腔镜手术不同,手助术式中一般先打开肝胃韧带薄弱部分,将胃控制于手中。用超声刀离断胃后壁与胰腺的粘连,打开胃胰皱襞,显露、离断胃冠状静脉及其分支。游离食管过程中需将胃和食管向下牵引,并用手指分辨胃壁和食管肌层的界限,可以较有效地避免损伤。
【注意事项】
1.术前合理选择患者,掌握适应证和禁忌证,进行充分准备,该手术主要适用于肝功能Child A或B级、既往有上消化道出血史的肝硬化门静脉高压症患者,应尽量做择期手术。
2.站位和体位 按本章所述站位方式,操作者与腹腔镜视野是同一方向,符合常规操作习惯,亦可减少相互干扰。右倾头低位可清楚显露脾周和脾门,进一步向右侧倾斜时可充分显露脾背面,进一步头低位便于处理脾门和贲门周围血管。
3.套管位置的选择 应根据脾脏的大小和位置合理布局,不要使套管位于脾脏投影范围内,更不要远离脾脏,导致脾脏切除后器械难以到达食管下端。
4.手助切口的选择 先建立观察孔,确认肝硬化情况、脾脏大小及周围粘连程度,根据情况决定切口在右上腹或正中线,如脾脏巨大,将辅助器置于右上腹更利于操作。
5.处理脾蒂时,利用二级脾蒂间隙仔细分离出脾上、下极血管分支,动静脉分别游离后用可吸收夹或钛夹闭合后离断。若曲张静脉太粗无法夹闭,或动静脉粘连紧密无法游离,可用丝线结扎压扁血管后再予夹闭。
6.门静脉高压症时,脾膈韧带和脾肾韧带内常为侧支循环建立之处,不仅血管丛生,还时有粗大的曲张静脉深藏其中,分离时应特别注意。
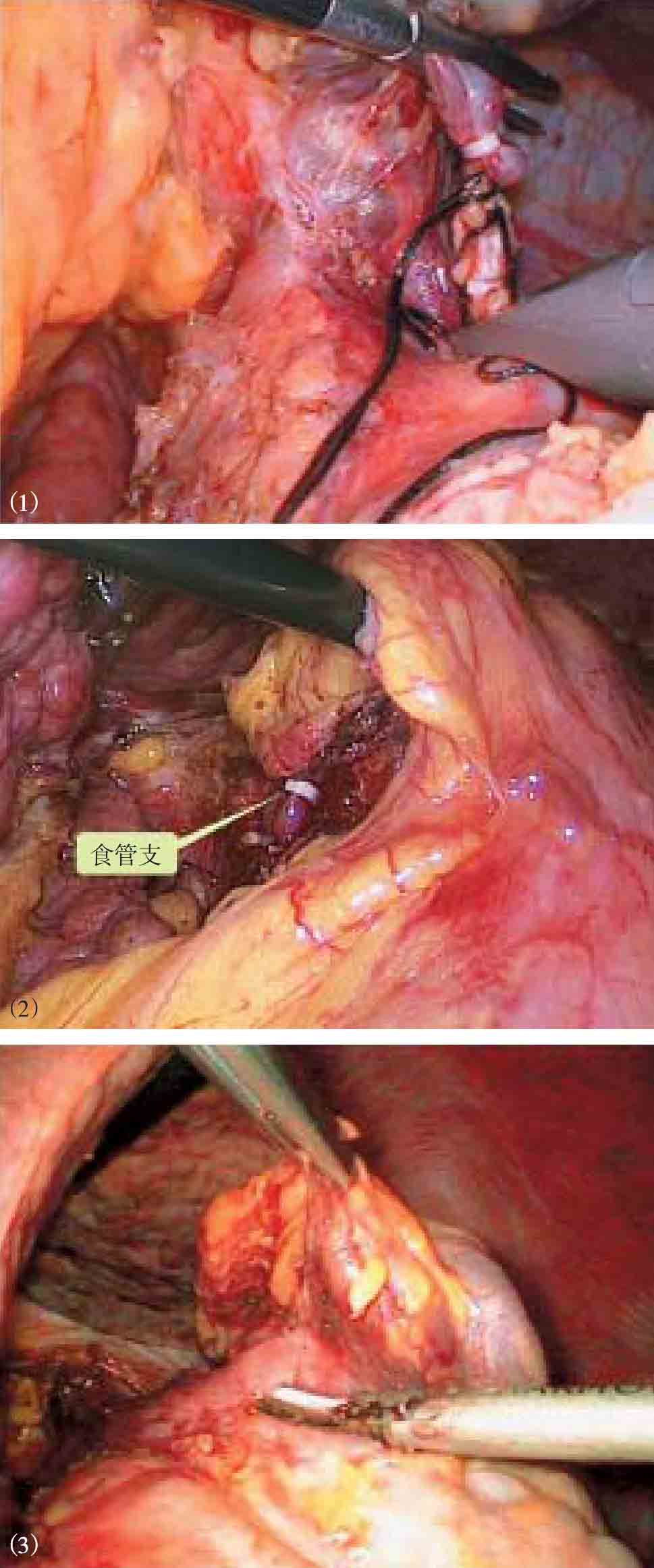
图10-30 腹腔镜下离断

(1)胃后血管;(2)食管支;(3)胃前壁曲张血管
7.在手助及改良手助术式中,术者应避免手对腹腔镜视野和手术操作的妨碍,而且在手术过程中不能过分依赖手进行操作,在诸如分离血管等精细操作时仍需要使用腔镜器械完成。此外,应注意避免手协助进行牵引和显露时过分牵动肠管带来的肠麻痹影响。
8.常规准备开腹器械,一旦发生大出血,应果断中转开腹或小切口手助腹腔镜手术。
【术后处理】
术后留置胃肠减压管,输血浆、白蛋白,利尿、护肝和预防感染。术后注意观察引流物性状,必要时检测引流液淀粉酶,了解有无胰漏。术后监测血小板,若高于500×10 9 /L,则口服肠溶阿司匹林50~75mg/d。术后7~15天行B超检查门静脉系统,术后15~30天复查上消化道造影。
【并发症及防治】
1.术中大出血
术中出血是腹腔镜脾切除加贲门周围血管离断术较为严重的并发症,也是中转开腹的主要原因,出血原因有全身因素和手术因素。肝硬化门脉高压症患者常有肝功能障碍,凝血机制异常,手术时出血难以自止,故术前要尽可能纠正,如输注凝血酶原复合物或纤维蛋白原等,血小板明显低下者需输入血小板悬液补充。术中出血的常见原因包括牵引器械导致的脾被膜撕裂、游离脾门时脾静脉损伤、分离过程中脆弱的曲张静脉出血等。门脉高压症患者的脾周围韧带中血管迂曲扩张,分离时稍有不慎极易导致不可控制的出血。故该术式对手术技术要求很高,初开展阶段适应证应限于正常或轻度增大的脾脏,再逐渐进步。术中需精细操作,尽可能逐一分离血管后夹闭切断,不可直接用超声刀切断。操作需轻柔,不可使用抓钳抓持或牵拉脾脏,应使用钝性器械、扇形牵开器或垫有纱布的抓钳,以免脾脏撕裂出血。术中出血若不能有效控制,应毫不犹豫中转开腹,不可反复尝试腹腔镜下止血。
2.术后出血
术后出血多发生于48小时以内,临床表现为腹腔出血,严重程度取决于出血量和速度。常见原因是术中止血不严格或凝血功能障碍导致手术创面渗血。防治原则是术前积极纠正,术中精细操作,仔细止血,术毕前仔细有序地检查创面。如出血经积极保守治疗不能控制,应及时手术探查。
3.左膈下积液、腹腔感染
多因术后脾窝积血积液引流不畅引起,表现为术后持续发热,白细胞升高,如继发细菌感染,则表现为高热不退、左季肋区疼痛、局部软组织水肿。防治原则是术中应彻底止血,放置有效引流,术后预防性使用抗生素。未形成脓肿前,应采用有效抗生素治疗,如已形成脓肿,可以在B超引导下穿刺置管引流或手术引流。
4.血栓形成
脾切除术后血小板升高,血栓常起源于脾静脉残端,可蔓延至门静脉。门静脉血栓形成常发生于术后2周血小板上升达高峰时,表现为上腹痛,恶心、呕吐、发热、血便等症状。防治重点在于术后常规监测血小板,根据检查结果及时给予药物预防。对可疑患者及时行彩色多普勒超声、CT、血管造影、磁共振血管成像等检查,有助于明确诊断和血栓形成的范围。治疗包括:①抗凝治疗为主要措施,对新近发生的血栓应做早期肝素或低分子肝素抗凝治疗,可使部分患者出现完全或广泛性再通,并防止血栓进展蔓延;②溶栓治疗,急性期可行溶栓治疗,包括局部或全身用药。近年来介入治疗水平的提高,更多采取经肠系膜上动脉局部用药;③介入治疗,常用方法为局部溶栓及机械碎栓,包括球囊血管成形术/栓子切除术,抽吸栓子切除术,网篮取凝血块术和使用多种工具机械血栓切除术。局部溶栓联合使用机械碎栓以及支架植入可减少溶栓时间和全身溶栓的危险性。介入治疗的常用途径有经皮穿刺肝内门静脉(PTPE)途径、经颈静脉穿刺肝内门静脉(TIPS)途径、经肠系膜上动脉途径。目前TIPS是门静脉血栓的较好治疗方案,也可同时作机械碎栓、局部溶栓、球囊扩张及支架术,无须经皮穿肝,穿刺道不经腹腔可减少溶栓出血风险,适用于腹水、凝血功能障碍者。由于可同时行介入性分流术,故可降低门静脉压力并增加门静脉血流速度,从而降低血栓的再发生率。
(陶凯雄 帅晓明 白洁)
参考文献
[1] 刘金钢,田忠. 腹腔镜脾切除贲门周围血管离断术应用及其评价[J],中国实用外科杂志,2010(3):183-186.
[2] Kawanaka H,Akahoshi T,Kinjo N,et al. Laparoscopic Splenectomy with Technical Standardization and Selection Criteria for Standard or Hand-Assisted Approach in 390 Patients with Liver Cirrhosis and Portal Hypertension[J],J Am Coll Surg,2015,221(2):354-366.
[3] 帅晓明,陈俊华,韩高雄,等. 改良手助腹腔镜和完全腹腔镜下脾切除加贲门周围血管离断术的比较研究[J],中华肝胆外科杂志,2013,19(1):36-40.
[4] Habermalz B,Sauerland,Decker G,et al. Laparoscopic splenectomy:the clinical practice guidelines of the European Association for Endoscopic Surgery(EAES)[J],Surg Endosc,2008,22(4):821-848.
[5] Hama T,Takifuji K,Uchiyama K,et al. Laparoscopic splenectomy is a safe and effective procedure for patients with splenomegaly due to portal hypertension[J],J Hepatobiliary Pancreat Surg,2008,15(3):304-309.
[6] Yamamoto J,Nagai M,Smith B,et al. Hand-assisted laparoscopic splenectomy and devascularization of the upper stomach in the management of gastric varices[J],World J Surg,2006,30(8):1520-1525.


