第六节
G蛋白偶联受体信号通路

一、G蛋白偶联受体信号通路简介
G蛋白偶联受体(guanosine-binding protein coupled receptor,GPCR)为7次跨膜的受体,由疏水的跨膜区和易变的亲水环构成,是迄今所知最大的跨膜受体蛋白质家族。
G蛋白是一类可以与GDP或GTP结合,具有GTP酶活性的蛋白质,可将信息传递过程中所结合的GTP水解成GDP。G蛋白可分为两类:大G蛋白和小G蛋白。大G蛋白是由Gα、Gβ及Gγ三个亚基组成的异三聚体,Gβ及Gγ亚基将Gα稳定在膜上。Gα亚基本身具有GTP酶活性,由于α亚基结构和作用不同,可分为激活型G蛋白(Gs)和抑制型G蛋白(Gi)。激活型的G蛋白在激活前,Gα与GDP结合,呈无活性状态,一旦受体与配体结合后,诱发G蛋白上Gα-GDP与GTP交换,成为活性状态的Gα-GTP。
与大G蛋白偶联的受体称为G蛋白偶联受体,该类受体共同的结构是7个跨膜的α螺旋,3个胞内环、3个胞外环,N-端在胞外,C-端在胞内(通常包含磷酸化位点),C-端和连接第5和第6个跨膜螺旋的胞内环上都有G蛋白的结合位点。GPCR在跨膜螺旋区的氨基酸序列都比较保守,而C-端、N-端和回环区域的氨基酸序列有显著差异,因此形成不同种类和功能的GPCR。此外,在GPCR基因表达过程中,基因突变造成的单核苷酸多态性、翻译后修饰造成的磷酸化和糖基化,以及与配体作用方式的差异,都会造成GPCR表型的多样性。
二、GPCR信号通路的功能
GPCR胞外的N-端可识别并结合环境中光、气味、激素、神经递质和肽类等信号,引起受体构象变化,激活G蛋白,后者将信号转导至胞内的效应分子,产生细胞反应。GPCR主要经由两条途径介导和调控生理功能:G蛋白途径和β-arrestin途径。传统的GPCR激动剂与受体结合后,激活G蛋白信号途径,包括钙离子、腺苷酸环化酶(adenyl cyclase,AC)等第二信使系统。β-arrestin途径主要由β-arrestin偏向性配体激活,G蛋白活化时,活化的GPCRs为主要结合配体,β-arrestin能与GRK(G蛋白偶联受体激酶)联合作用,使GPCRs发生脱敏反应,调节受体内吞、循环、复敏、降解、信号转导等功能;在G蛋白不被激活的情况下,β-arrestin也可通过活化的GPCRs或其他的受体直接启动信号转导(图2-4-7)。
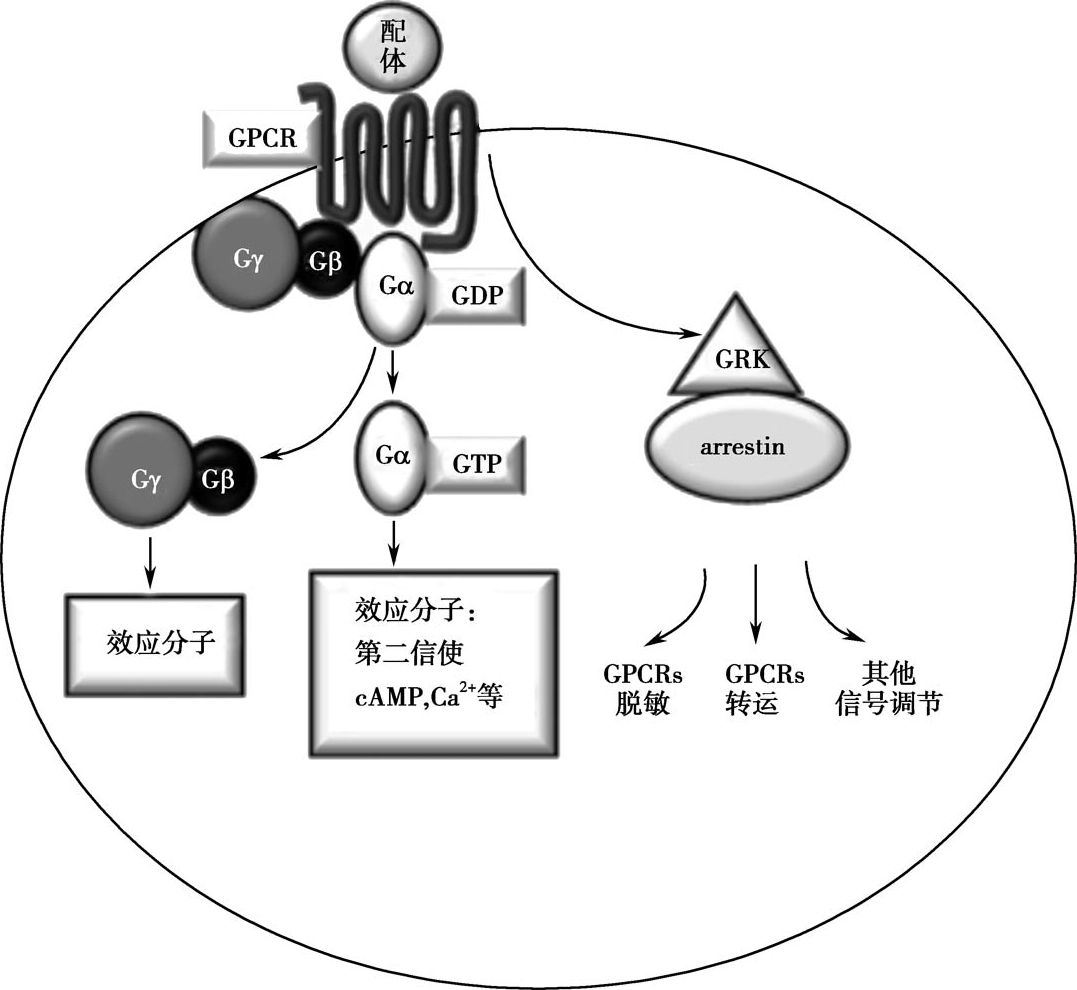
图2-4-7 GPCR信号通路

(资源8) GPCR信号通路(彩图)
三、GPCR信号通路与临床
GPCR几乎分布在所有的器官和组织内,参与许多重要的信号转导过程。如,感光受体调控视觉,嗅觉受体决定气味识别,肾上腺素受体参与调控心率及血压,趋化因子受体参与免疫系统发育和炎症的发生发展,脂肪酸受体参与能量代谢过程,腺苷受体参与神经发育和组织损伤保护,阿片受体调控痛觉及药物成瘾等。GPCR功能异常将引起一系列疾病的发生,因此它是药物研发最重要、最成功的靶点。据统计,世界上约45%的临床药物直接靶向GPCR及其信号转导途径,以GPCR受体为靶点的药物已广泛应用于心脑血管疾病、胃肠系统疾病、糖尿病、癌症、免疫系统疾病、过敏反应和中枢神经系统疾病的治疗。另外,GPCR的激动剂和拮抗剂也具有广泛的疗效谱,包括疼痛(阿片受体激动剂,如吗啡)、哮喘(β肾上腺受体激动剂,如沙美特罗)、消化道溃疡(组胺受体拮抗剂,如雷尼替丁)和高血压(血管紧张素受体拮抗剂,如氯沙坦)等。


