第四章
食管疾病
第一节
胃食管反流病

陈坚 徐三荣
胃食管反流病(gastroesophageal reflux disease,GERD)系指胃内容物反流入食管,引起不适和并发症的一种疾病。GERD可分为非糜烂性反流病(non-erosive reflux disease,NERD)、糜烂性食管炎(erosive esophagitis,EE)和Barrett食管(Barrett's esophagus,BE)三种类型,以 NERD最为常见,约占70%;EE可合并食管狭窄、溃疡和消化道出血;BE有可能发展为食管腺癌。
【流行病学】
胃食管反流的流行率有明显的地理差异。在西方较为常见,但亚洲的流行率也在逐年上升。1998年北京和上海、西安地区GERD流行病调查显示:胃食管反流症状的发生率分别为8.97%及10.98%;GERD的患病率分别为5.77%及3.87%;EE发病率分别为1.92%及2.40%。
【病因和发病机制】
1.LES抗反流的屏障功能减弱
下食管括约肌(lower esophageal sphincter,LES)是食管-胃连接处抗反流的第一道屏障。GERD患者的LES静息压明显低于正常。LES的舒缩受神经、体液控制,也受胃肠激素的影响。胆碱能和β-肾上腺素能拟似药、α-肾上腺素能拮抗剂、多巴胺、地西泮、钙离子拮抗剂、吗啡等药物,脂肪、咖啡等食物,抽烟、酗酒等不良嗜好和不良精神刺激均可引起LES的压力异常。正常人腹内压增加时能通过迷走反射引起LES收缩。当举重、弯腰或作Valsaval动作致腹压升高时,若LES的压力不能同步升高,易引起胃食管反流。
2.食管对胃反流物的廓清能力障碍
胃酸和胃蛋白酶是食管黏膜的主要损害因子。此外,反流物中还常混有含胆汁、胰酶及溶血卵磷脂的十二指肠液。胃酸和胆汁酸在食管黏膜的损害中具有协同作用,胆汁也可单独引起食管炎症。正常食管对反流物的廓清能力包括食管排空与唾液中和两部分。此外,唾液对食管的冲刷作用、唾液内的碳酸氢盐(pH 6~7)对反流物中酸的中和作用、坐立位时反流物的重力影响,都参与胃反流物的清除。当某些疾病如黏膜炎症、硬皮病等导致食管肌肉或神经受损时,则可因蠕动障碍而引起食管廓清能力下降。
3.食管黏膜屏障功能的损害
食管黏膜屏障由前上皮屏障、上皮屏障和后上皮屏障三部分组成。前上皮屏障主要包括食管黏膜表面黏液层、不动水层、表面
 复合物和黏膜表面活性物质。上皮屏障包括结构屏障和功能屏障。结构屏障由角质层上皮细胞的管腔侧细胞膜、上皮细胞间连接复合物和上皮细胞扭曲复杂的间隙组成。结构屏障具有很高的电阻,可维持对H
+
等的低通透性。功能屏障包括细胞内和细胞间缓冲系统、细胞膜上的离子转运系统。后上皮屏障主要包括食管血供、食管上皮损伤后的修复机制。当上述屏障功能受损时,即使在生理反流情况下,亦可引起食管炎症。
复合物和黏膜表面活性物质。上皮屏障包括结构屏障和功能屏障。结构屏障由角质层上皮细胞的管腔侧细胞膜、上皮细胞间连接复合物和上皮细胞扭曲复杂的间隙组成。结构屏障具有很高的电阻,可维持对H
+
等的低通透性。功能屏障包括细胞内和细胞间缓冲系统、细胞膜上的离子转运系统。后上皮屏障主要包括食管血供、食管上皮损伤后的修复机制。当上述屏障功能受损时,即使在生理反流情况下,亦可引起食管炎症。
4.GERD发病的其他因素
(1)裂孔疝和GERD:
不少GERD患者伴有裂孔疝(hiatal hernia)。裂孔疝合并GERD的机制可能是LES张力低下和(或)出现频繁的LES自发松弛有关。裂孔疝可能影响LES关闭或增强感觉刺激以致发生LES松弛。此外,卧位时疝囊有存液作用,吞咽时LES松弛,容易促使反流发生。
(2)食管胃角:
也称 His角、His瓣,是指食管腹内段与胃底所形成的夹角,正常情况下为一锐角。进食后胃底容受性舒张可使His瓣贴向食管壁,阻止胃内容物返向食管,起到抗反流作用。如果His角变钝或胃底容受性舒张障碍会影响His瓣的作用,容易发生反流。
(3)心理社会因素:
心理社会因素可以通过精神内分泌途径影响食管和胃的动力。有资料提示催眠疗法、行为认知疗法、抗抑郁或抗焦虑治疗可能对反流性食管炎的治疗有益。
【病理生理改变】
GERD涉及的病理生理因素包括:滑动型食管裂孔疝、LES压力下降、TLESR、酸度、肥胖、胃食管连接处扩张性增高、食管酸廓清时间延长、胃排空延迟等。影响GERD症状感觉的因素包括:反流液的酸度、反流位置、反流物中存在气体、胃十二指肠反流、纵行肌收缩、黏膜完整性、外周及中枢致敏机制等。
EE可据不同的发展阶段分为三期,即早期、中期和晚期。其中早期病变最具特性,而中、晚期则与其他类型的食管炎难以鉴别。很多学者以Ismail-Beigi的早期反流性食管炎为病理诊断标准:①基底细胞增生,其厚度超过黏膜上皮厚度的15%(正常厚度约10%);②固有膜乳头深度增加,其深度大于上皮厚度的66%(正常厚度小于66%)。仅凭上述改变,甚至在没有其他组织学异常表现的情况下,也可确定EE的诊断。国际上对BE的诊断存在两种见解:①只要食管远端鳞状上皮被柱状上皮取代,即可诊断为BE;②只有食管远端柱状上皮化生并存在肠上皮化生时才能诊断。鉴于我国对BE的研究还不够深入,因此以食管远端存在柱状上皮化生作为诊断标准较为稳妥,但必须详细注明组织学类型及是否存在肠上皮化生。内镜与病理诊断相结合有助于BE深入研究。
尽管NERD在胃镜下表现阴性,也无统一的NERD病理学诊断标准,但NERD可有一定的病理改变:如表层细胞肿胀,灶状基底细胞增生,炎症细胞浸润,上皮乳头内血管扩张、充血等表现。
【临床表现】
反流性食管炎的临床表现可分为典型症状、非典型症状和消化道外症状。典型症状有胃灼热、反流;非典型症状为胸痛、上腹部疼痛和恶心、反胃等;消化道外症状包括口腔、咽喉部、肺及其他部位(如脑、心)的一些症状。
1.胸骨后烧灼痛
又称胃灼热,症状多在进食后1小时左右发生,半卧位、躯体前屈或剧烈运动可诱发,而过热、过酸食物则可使之加重。烧灼感的严重程度不一定与病变的轻重一致。严重食管炎尤其在瘢痕形成者可无或仅有轻微烧灼感。
2.胃-食管反流
每于餐后、躯体前屈或卧床时有酸性液体或食物从胃、食管反流至咽部或口腔。此症状多在胸骨后烧灼痛发生前出现。
3.咽下困难
初期常可因食管炎引起继发性食管痉挛而出现间歇性咽下困难。后期由于食管瘢痕形成狭窄,烧灼痛反而减轻而为永久性咽下困难所替代,进食固体食物时可在剑突处引起堵塞感或疼痛。
4.消化道外症状
反流液可侵蚀咽部、声带和气管而引起慢性咽炎、慢性声带炎和气管炎,临床上称之Delahunty综合征。胃液反流及胃内容物吸入呼吸道尚可致吸入性肺炎。近年来的研究已表明GERD与部分反复发作的哮喘、咳嗽、声音嘶哑、夜间睡眠障碍、咽炎、耳痛、龈炎、癔球症、牙釉质腐蚀等有关。婴儿LES尚未发育,易发生GERD并引起呼吸系统疾病甚至营养、发育不良。目前对GERD的研究已从胃肠专业涉及到呼吸、心血管、耳鼻喉科及儿科等多领域。
【辅助检查】
(一)X线检查
传统的食管钡餐检查将胃食管影像学和动力学结合起来,可显示有无黏膜病变、狭窄、裂孔疝等,并显示有无钡剂的胃食管反流,因而对诊断有互补作用,但敏感性较低。
(二)内镜检查
鉴于我国是胃癌、食管癌高发国家,因此对拟诊患者一般先行内镜排查,特别是症状发生频繁、程度严重、伴有报警征象或有肿瘤家族史的患者。上消化道内镜检查有助于确诊糜烂性食管炎以及有无合并症和并发症:如裂孔疝、食管炎性狭窄、食管癌等,同时有助于诊断及评估本病的严重度。目前GERD的内镜下分级标准沿用洛杉矶标准,即A~D四级。
(三)高分辨率食管测压(HRM)
根据食管HRM的导管和测压原理,分为21-36通道的水灌注HRM和测压通道高达33-36通道的固态HRM。此后又发展出了3DHRM技术。HRM除帮助食管pH电极定位、术前评估食管功能和预测手术外,还能预测抗反流治疗的疗效和是否需长期维持治疗。因此,食管测压能帮助评估食管功能,尤其是对治疗困难者。GERD行食管测压的主要阳性表现包括:①LES压力下降、TLESR发生频繁、合并裂孔疝;②食管体部动力障碍等。

(资源52) 正常食管HRM(彩图)
(四)24小时食管pH监测
即将一微探头经鼻插入食管LES上方5cm处,记录24小时中所有反流活动。24小时食管pH监测能详细显示酸反流、昼夜酸反流规律、酸反流与症状的关联以及患者对治疗的反应,使治疗个体化,推荐在内镜检查和PPI试验后仍不能确定反流时应用。检测指标包括:①总酸暴露时间:24小时总的、立位、卧位pH<4的总时间百分率;②酸暴露频率:pH<4的次数;③酸暴露的持续时间:反流持续时间≥5分钟的次数和最长反流持续时间。根据pH监测的有关参数由计算机测算酸反流积分。无线pH监测技术(Brava胶囊)可以分析48~72小时的食管pH变化,提高患者检测时的舒适度及依从性,有助于更好地了解酸反流与临床症状之间的相关性。

(资源53) 24小时食管pH监测日志(彩图)
(五)多导腔内电阻抗(MII)
可以不借助胃酸来确认食管内食物团块的存在,它可以同时监测酸、弱酸或非酸反流。MII通常与测压或pH监测相结合。当结合测压时,多导腔内阻抗测压法(MII-EM)能提供食管收缩及食物团块输送的信息。当结合pH监测时,24小时pH-多导腔内阻抗监测法(MII-pH)可以检测到不依赖pH改变的胃食管反流信息(包括酸和非酸反流)。通过MII-pH检测,可以明确反流的分布及清除;依据pH值的变化可简单区分酸与非酸反流;根据 MII检测可区分反流物为液体、气体、或混合反流。MII-pH已成为诊治GERD的“金标准”,可以指导药物选择、手术治疗、内镜下抗反流治疗。
【诊断和鉴别诊断】
完整而准确的病史是GERD诊断的基础。对于伴有典型反流症状群又缺乏报警症状的患者,可行质子泵抑制剂(PPI)诊断性治疗:服用标准剂量PPI一日两次,疗程1~2周。服药后若症状明显改善则为PPI试验阳性,支持GERD的诊断;若症状改善不明显则为PPI试验阴性,不支持该诊断。PPI试验已被证实是GERD诊断简便、无创、敏感的方法,缺点是特异性较低。PPI试验阴性有以下几种可能:①抑酸不充分;②存在酸以外的诱发因素;③症状非反流引起。
对于PPI治疗无效或具有报警症状(吞咽困难、吞咽痛、出血、体重减轻或贫血)的患者应行进一步检查。若内镜发现食管下段有明显黏膜破损及病理支持的炎症表现,则EE诊断明确。NERD主要依赖症状进行诊断,患者以反流、胃灼热为主诉时,如能排除可能引起胃灼热症状的其他疾病,且内镜检查未见食管黏膜破损及其他器质性疾病,即可作出NERD的诊断。根据24小时食管pH测定结果,NERD可分为下列3个亚型:①食管有异常酸暴露;②食管测酸在正常范围,但超过50%的胃灼热症状发作与“生理性”酸反流相关,推测食管对酸敏感;③胃灼热症状与酸反流无关,这被认为是功能性胃灼热,主要与内脏敏感性增高有关。
【治疗】
治疗目的:①愈合食管炎症,消除症状;②防治并发症;③提高生活质量,预防复发。治疗包括调整生活方式、内科、外科和内镜治疗。具体措施有:抑酸以提高胃内pH;增加食管对酸、碱反流物的清除;促进胃排空;增加LES张力。
(一)调整生活方式
体位是减少反流的有效方法,如餐后保持直立,避免过度负重,不穿紧身衣,抬高床头等。肥胖者应减肥。睡前3小时勿进食以减少夜间的胃酸分泌。饮食宜少量、高蛋白、低脂肪和高纤维素,戒烟、限制咖啡因、酒精、巧克力及酸辣食品。许多药物能降低LES的压力,如黄体酮、茶碱、PGE 1 、PGE 2 和 PGA 2 、抗胆碱药、β受体兴奋剂、α受体阻断药、多巴胺、地西泮和钙通道阻滞剂等,在应用时应加以注意。
(二)内科药物治疗
药物治疗的目的在于加强抗反流屏障功能,提高食管清除能力,改善胃排空与幽门括约肌功能以防止胃、十二指肠内容物反流,保护食管黏膜。
(1)抑酸剂:
包括质子泵抑制剂(PPI)和 H 2 受体拮抗剂(H 2 RA)。PPI能持久抑制基础与刺激后胃酸分泌,是治疗GERD最有效的药物。PPI常规或双倍剂量治疗8周后,多数患者症状完全缓解,EE得到愈合。但由于患者LES张力未能得到根本改善,故停药后约80%会在6个月内复发。所以推荐在愈合治疗后继续维持治疗1个月。若停药后仍有复发,建议在再次取得缓解后按需维持治疗:在PPI中任选一种,当有症状时及时用药。为防止夜间酸突破的发生,对部分须严格控制胃酸分泌的患者,可以在PPI早晨1次的基础上,临睡前加用H 2 受体拮抗剂1次,二者有协同作用。此外,洛杉矶分级LA-C/D,合并裂孔疝的GERD患者需要加倍剂量的PPI。
(2)制酸剂和黏膜保护剂:
制酸剂沿用已久,如氢氧化铝、碳酸钙、铝碳酸镁等。铝碳酸镁对黏膜也有保护作用,同时能可逆性吸附胆酸等碱性物质,使黏膜免受损伤,尤其适用于非酸反流相关的GERD患者。黏膜保护剂种类繁多,能在受损黏膜表面形成保护膜以隔绝有害物质的侵蚀,有利于受损黏膜的愈合。
(3)促动力药:
如多潘立酮、莫沙必利、伊托必利等。多潘立酮为选择性多巴胺受体拮抗剂,对食管和胃平滑肌有显著促动力作用;莫沙必利是5-羟色胺受体4(5-HT4)激动剂,对全胃肠平滑肌均有促动力作用;伊托必利具有独特的双重作用机制,既可阻断多巴胺D 2 受体,也可抑制乙酰胆碱酯酶活性,同时还能提高LES的张力,对心脏无不良影响。
(4)联合用药:
抑酸与促动力药物的联合应用是目前治疗GERD最常用的方法,与单用PPI相比,联用促动力药物通过抑制反流和改善食管廓清及胃排空能力起到协同作用。巴氯芬是一种γ-氨基丁酸b型受体激动剂,巴氯芬20mg,每日3次,可以明显抑制TLESR的发生;MII/pH阻抗监测显示巴氯芬可以明显减少非酸反流,但对食管酸暴露没有影响。巴氯芬停药前要逐渐减量,以防症状反跳。
(5)个体化用药:
可根据临床分级个体化用药。轻度可单独选用PPI、促动力药或H 2 RA;中度宜采用PPI或H 2 RA和促动力药联用;重度宜加大PPI口服剂量,或PPI与促动力药联用。对久治不愈或反复发作伴有明显焦虑或抑郁者,应加用抗抑郁或抗焦虑治疗(如5-羟色胺再摄取抑制剂或5-羟色胺及去甲肾上腺素再摄取抑制剂)。
(三)GERD的内镜下治疗
内镜手术适应证包括:①中、重度反流性食管炎,经内科治疗无效;②经久不愈的食溃疡及出血;③合并食管裂孔疝;④年轻人需长期大量药物治疗;⑤反复发作的食管狭窄;⑥反复并发肺炎等。2000年4月,美国FDA批准Stretta和EndoCinch两种内镜手术治疗GERD;前者是对LES区实施热凝固,后者是对贲门做缝合折叠,二者都可使GERD患者对药物治疗的依赖性减低,但长期安全性及有效性仍有待随访。对于并发食管狭窄的患者,应当首选扩张治疗。
Barrett食管约见于10%~15%的GERD患者。内镜检查时如发现上皮呈微红色,自胃延伸至食管腔,即可疑及此症。当长度>3cm时,称为长段BE,<3cm时为短段BE。BE一般预后良好,但考虑到BE发生食管腺癌的风险比一般人群高30倍以上,故应定期内镜随访。BE的内镜下治疗包括氩离子激光凝固术、消融术、内镜下黏膜剥离术等。
(四)GERD的手术治疗
主要适应证:①年龄较轻,手术条件好的患者,可作为药物维持疗法的另一选项;②控制反流及其诱发的吸入性肺炎。药物治疗失败不是手术治疗的指征,这往往表明症状不是反流引起,而与内脏敏感性增高或焦虑、抑郁有关。手术治疗的首选方法是腹腔镜下Nissen胃底折叠术。手术成功率约85%~90%;死亡率约0.2%;再发率约2%~8%。术后并发症可有咽下困难和气胀综合征(不能嗳气呕吐)。但是手术不能使症状根本治愈(50%以上患者仍需再次接受药物治疗),也不能预防食管癌的发生。对无法停药且手术条件好的患者,手术治疗比终生服药更为可取,控制反流症状比药物疗法好。
(五)难治性GERD的诊疗
双倍剂量的PPI治疗8~12周后胃灼热和(或)反流等症状无明显改善者称为难治性GERD。首先需检查患者的依从性,并优化PPI使用。在药物的选择方面,抑酸强度高、个体间代谢速率差异小的PPI(如埃索美拉唑)是优选。难治性GERD患者需进行食管阻抗-pH监测及内镜检查等评估。若反流监测提示存在症状相关酸反流,可增加PPI剂量和(或)换一种PPI,或在权衡利弊后行抗反流手术治疗。GERD伴食管外症状的患者PPI治疗无效时需进一步评估,寻找相关原因。
主要参考文献
1.中华医学会消化病学分会.2014《中国胃食管反流病共识意见》.中国医学论坛报,2014,7(4):233-237.
2.Fuchs KH,Babic B,Breithaupt W,et al.EAES recommendations for the management of gastroesophageal reflux disease.Surg Endosc,2014,28(6):1753-1773.
3.Hopper AD.Improving the diagnosis and management of GERD in adults.Practitioner,2015,259(1781):27-32.
第二节
食管动力性疾病

陈坚 徐三荣
食管是一个有独立运动形式及神经支配的器官。吞咽是由下咽部、上食管括约肌、食管体部、下食管括约肌松弛或收缩产生的协调运动。食管动力紊乱患者常有吞咽困难、胸骨后疼痛等表现。
食管动力性疾病首先要明确系原发性或继发性运动紊乱。继发性食管动力障碍可源于胃食管反流病、肿瘤(如食管、贲门癌)、炎症感染(如食管念珠菌病、北美锥虫病,即Chagas病)、结缔组织疾病(如系统性硬化症)、神经肌肉病变(如糖尿病神经病变、肌萎缩侧索硬化、特发性假性小肠梗阻)、代谢紊乱(系统性淀粉样变、酒精中毒)等。原发性食管动力障碍包括贲门失弛缓症、胡桃夹食管、弥漫性食管痉挛、下食管括约肌高压症及非特异性食管动力障碍等。食管动力障碍可表现为动力过强、动力减弱或紊乱。
弥漫性食管痉挛以高压型食管蠕动异常为动力学特征的原发性食管运动障碍疾病,病变主要在食管中下段,表现为高幅的、为时甚长的、非推进性的重复性收缩,致使食管呈串珠状或螺旋状狭窄,而上食管及下食管括约肌常不受累。
胡桃夹食管以心绞痛样胸痛发作和吞咽困难为特征。胡桃夹食管的特点为食管具有高振幅(可达150~200mmHg)、长时间(>60s)的蠕动性收缩,但食管LES功能正常,进餐时可松弛。
贲门失弛缓症的主要特征是食管缺乏蠕动,下食管括约肌高压和对吞咽动作的松弛反应减弱。临床表现为咽下困难、食物反流和胸骨后不适或疼痛。
在有吞咽困难,胸骨后疼痛的患者中,若排除了继发于器质性疾病的可能,同时食管测压显示紊乱的运动波形且这种波形又不是典型的贲门失弛缓症、弥漫性食管痉挛或胡桃夹食管时,就用非特异性食管动力障碍来描述。
【辅助检查】
1.食管高分辨率测压(high resolution manometry,HRM)
芝加哥标准根据LES和膈脚的相对位置关系将胃食管连接部分为3型,同时还可发现双高压力带的存在,从而明确裂孔疝的诊断。HRM将贲门失弛缓症分为3型。(测压的参数及参考值参见表15-4-1)、(原发性和继发性食管动力异常的测压特点见表15-4-2)。

(资源54) 食管裂孔疝-双高压带(彩图)

(资源55) 贲门失弛缓(彩图)
表15-4-1 正常食管测压常用的参数

表15-4-2 原发性和继发性食管动力异常的测压特点

(资源56) 食管无蠕动(彩图)
2.多导腔内电阻抗(multi-intraluminal impedance,MII)
将阻抗电极置于食管中,由于不同的物质(气体、液体、固体)具有不同的阻抗值,可据此了解食管内容物的物理性质、走行状态。阻抗技术目前多与pH监测或HRM联用,分别称为24小时pH-MII技术和高分辨率阻抗测压技术。24小时pH-MII技术:可以明确有无反流,反流物的理化性质,区分酸和非酸反流,气体反流与混合反流,对于明确胃食管反流病的病因有重要意义。高分辨率阻抗测压技术可以在了解食管各部位压力的同时明确食物团块被推进和通过胃食管连接部进入胃内的全过程,多方位地明确食管动力状况。
3.食管X线钡剂检查
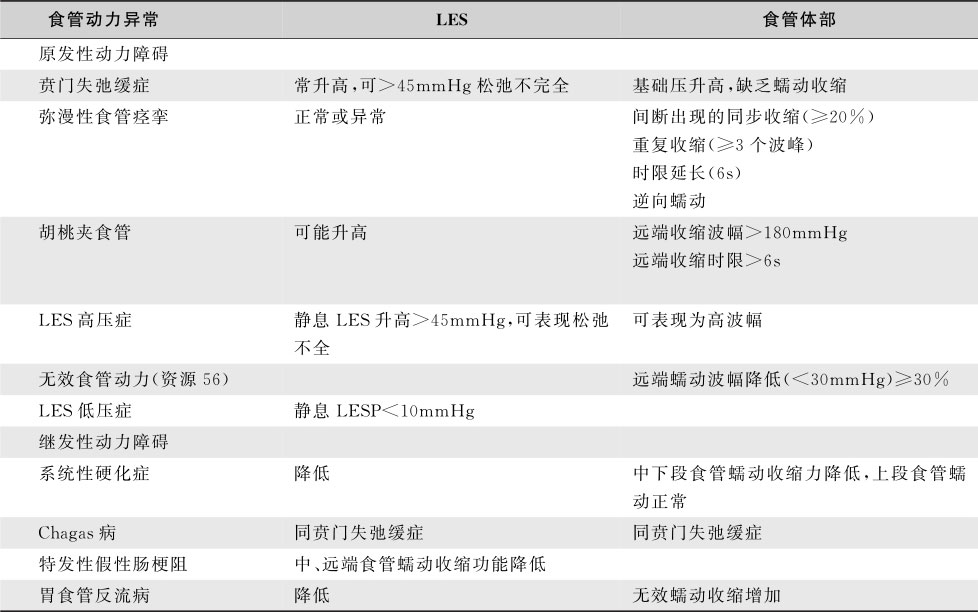
贲门失弛缓症时可见食管的推进性收缩波消失,其收缩具有紊乱及非蠕动性质;LES不随吞咽松弛,而呈间断开放,可见少许造影剂从食管漏入胃内。钡剂充盈时,食管体部明显扩张,末端变细呈鸟嘴状(图15-4-1A)。胡桃夹食管时钡餐可见食管蠕动波仅达主动脉弓水平,食管下2/3为一种异常强烈的、不协调的、非推进性收缩所取代,因而食管腔出现一系列同轴性狭窄,致使食管呈螺旋状或串珠状(图15-4-1B)。
4.食管传输时间测定
测定固体、半固态或液体从咽部至胃时通过食管全长的时间。可采用核素法、钡剂法或吞水音图检查等。主要用于估计食管动力障碍的程度,也可评判治疗疗效。核素法还能测算节段性食管传输时间。
【发病机制】
贲门失弛缓症、弥漫性食管痉挛、胡桃夹食管和其他非特异性原发动力紊乱是食管肌肉抑制性和兴奋性失衡所致。贲门失弛缓症属神经源性疾病,病变可见食管壁内迷走神经及其背核和食管壁肌间神经丛中神经节细胞减少,甚至完全缺如,但LES内的减少比食管体部要轻所致。尸检证明食管痉挛患者食管肌有过度肥厚。
【临床表现】
1.胸痛
表现为胸骨后或剑突下挤压性绞痛或烧灼样疼痛,也可为钝痛。疼痛可向下颌、颈部、上肢或背部放射,部分患者疼痛发作与进食、体力活动和体位(如卧位和弯腰)有关。部分患者口服抗酸剂或硝酸甘油疼痛可缓解。疼痛可能与食管平滑肌强烈收缩或食物潴留性食管炎有关。
2.食管症候群
包括胃灼热、反酸、上腹部灼烧感、吞咽困难或吞咽痛等。症状的轻重与原发病有关:例如弥漫性食管痉挛,患者多有进食疼痛、哽噎感,进食刺激性食物可诱发;贲门失迟缓时反流物因未进入胃腔,故无呕吐物酸臭的特点;并发食管炎、食管溃疡时反流物可含有血液。
3.食管外症候群
见于继发于胃食管反流,当夜间反流严重时,吸入导致慢性肺支气管病变,患者有咳嗽、咳痰和呼吸困难或哮喘等主诉。
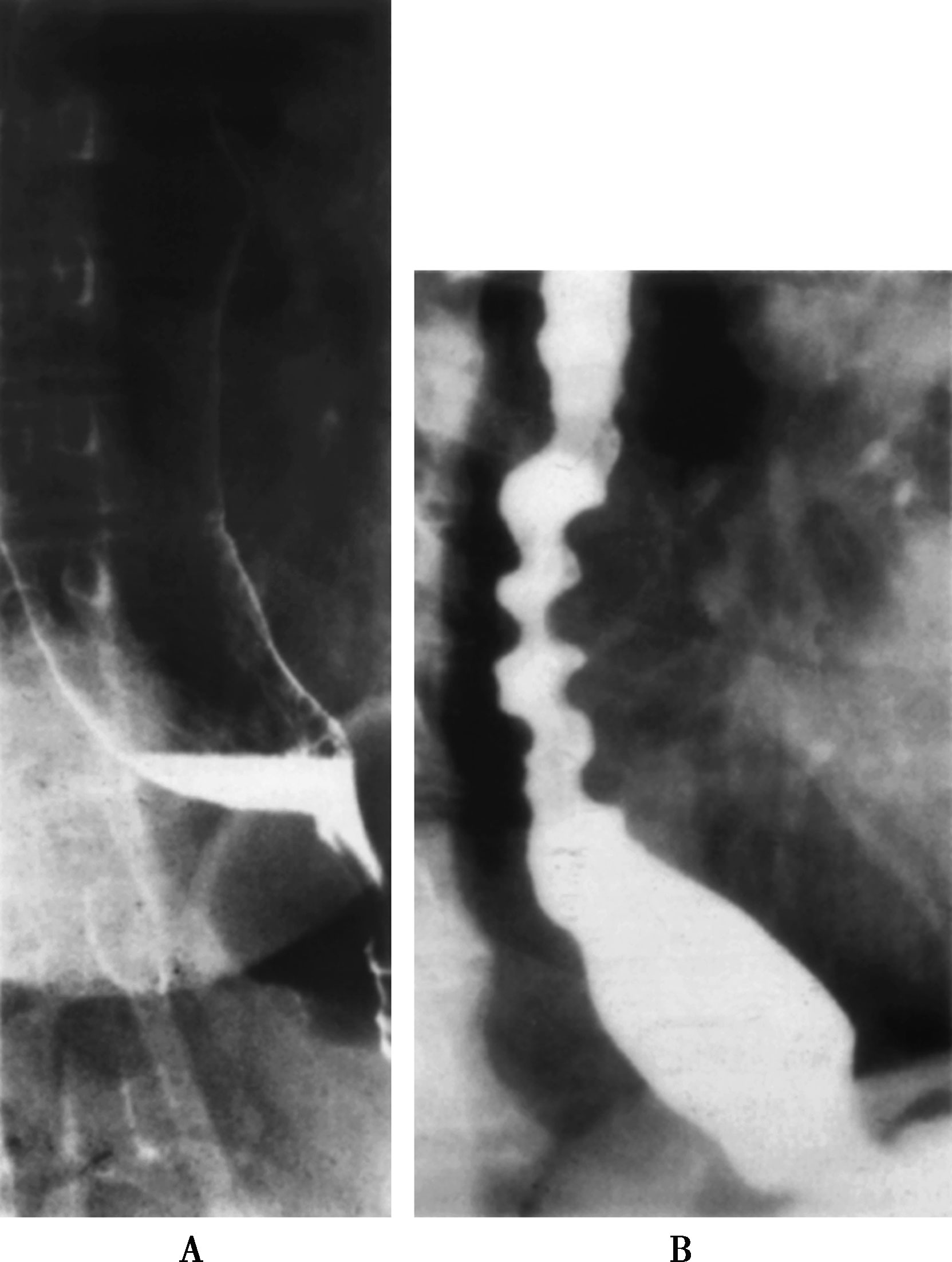
图15-4-1
A.贲门失弛缓症的食管X线表现;B.X线吞钡检查显示开塞钻食管
【诊断程序】
食管动力性疾病必须结合临床表现和各种检查方法,才能作出正确的病因学诊断。对反复发作的胸骨后疼痛患者,首先应进行心血管方面的排查,然后进行食管钡剂造影、上消化道内镜检查,以明确食管是否有功能或结构的异常。必要时进行食管动力学特殊监测。部分患者胸痛与食管异常的因果关系不易确立,尚需进行激发试验。为提高阳性检出率,可进行联合检查。
【治疗】
对于继发性食管动力疾病,必须首先治疗其原发病。
1.贲门失弛缓症的治疗
尚无有效方法恢复已损害的肌间神经丛功能。对本病的治疗目的在于解除LES的松弛障碍,降低LES的压力,预防并发症。治疗手段主要有:药物治疗(硝酸甘油类和钙离子拮抗剂)、肉毒杆菌毒素注射、球囊扩张和LES切开[包括经口内镜下肌切开术(POEM)及腹腔镜下Heller肌切开术]。药物治疗疗效最差,维持时间最短;其次是肉毒素注射治疗和球囊扩张,POEM微创手术疗效最持久。根据HRM的检测结果,贲门失弛缓症可分为3种亚型:Ⅰ型(食管体部无蠕动)对肌切开术效果较好;Ⅱ型(食管体部同步增压)对各种治疗效果均较好;Ⅲ型(食管体部弥漫性痉挛)对各种治疗效果均较差。
2.食管蠕动失调和高张性食管动力紊乱的治疗
药物治疗可改善弥漫性食管痉挛、胡桃夹食管、高压性LES和非特异性食管运动障碍的症状,常用药物有硝酸甘油类、抗胆碱能药物、钙离子拮抗剂等。整个食管远端的纵行肌切开术可作为缓解症状的最后手段,但罕有施行。
3.食管动力紊乱者躯体症状的治疗
使患者充分了解这是良性病变,解除思想顾虑。有焦虑、抑郁明显者可进行心理暗示治疗,同时可给予镇静安眠类药物如地西泮、曲唑酮、多塞平、5-羟色胺重摄取抑制剂等治疗。
主要参考文献
1.Castro SP,Drepper M,Grignoli R,et al.Achalasia:which treatment to choose in 2015.Rev Med Suisse,2015,11(484):1587-1591.
2.Torresan F,Ioannou A,Azzaroli F,et al.Treatment of achalasia in the era of high-resolution manometry.Ann Gastroenterol,2015,28(3):301-308.
3.Müller M,Gockel I.Esophageal motility disorders.Internist(Berl),2015,56(6):615-624.
第三节
食管感染性疾病

刘 杰
食管感染(esophageal infections)在普通人群中比较少见,多见于免疫缺陷人群中。I型单纯疱疹病毒(HSV-1)、巨细胞病毒(CMV)、白念珠菌是最常见的3种病原体。主要表现为不同程度的吞咽痛,常可伴吞咽困难、体重下降、消化道出血等,部分患者可无明显症状。一般预后良好,如治疗不及时,可引发并发症。
【危险因素与病原体】
(一)食管感染的常见危险因素
包括:①恶性肿瘤,接受放射治疗或抗肿瘤药物治疗者;②器官移植、接受免疫抑制剂治疗;③人类免疫缺陷病毒(HIV)感染或先天性免疫功能缺陷患者;④某些慢性病,如糖尿病或再生障碍性贫血;⑤长期广谱抗生素或类固醇激素使用;⑥反流性食管炎,食管黏膜有明显糜烂或溃疡者;⑦酗酒;⑧年龄。
(二)食管感染的常见病原体
1.真菌性食管炎
最常见的真菌是白念珠菌。白念珠菌是咽喉部的共生菌,在某些诱发因素下,如免疫抑制、糖尿病、大量使用抗生素等,可成为致病菌引发食管炎。患者通常没有明显症状。
2.病毒性食管炎
Ⅰ型单纯疱疹病毒、水痘-带状疱疹病毒(HZV)、巨细胞病毒、人乳头瘤病毒(HPV)和EB病毒等均可引发,以HSV-1及CMV最常见,在食管感染性疾病中仅次于白念珠菌。HSV-1及CMV感染主要见于免疫缺陷患者,其中HSV-1感染亦可见于部分免疫功能正常的患者中,如胃食管反流或食管医疗器械操作损伤食管黏膜。HPV感染可无明显症状,是食管鳞状细胞癌的危险因素之一。
3.细菌性食管炎
通常发生于免疫抑制宿主,常见病原体有乳酸菌和β-溶血性链球菌。在严重的粒细胞缺乏和肿瘤患者中,因患者可合并其他病原体如病毒和真菌感染,细菌感染经常会被忽视。
4.其他病原体
如梅毒性食管炎,又称食管梅毒,由梅毒螺旋体感染引起,极为罕见。
【临床表现】
1.食管表现
吞咽痛或吞咽困难、咽喉部异物感、自发性胸骨后疼痛或烧灼感、舌或咽喉部白斑或溃疡。
2.口腔损害
通常也能为食管炎诊断提供依据,特别是在AIDS患者中,鹅口疮可见于大部分患有食管念珠菌病的AIDS患者;口咽部疱疹或溃疡很可能提示伴随食管HSV感染或阿弗他溃疡。
3.全身表现
体重下降和胃肠道出血等,也有表现为发热、恶心、呕吐或腹痛,经内镜检查证实有食管炎症。
4.并发症表现
如食管狭窄、食管支气管窦道形成、食管穿孔等。
【辅助检查】
(一)影像学检查
有助于感染性食管炎的诊断,但诊断价值有限。
部分患者X线吞钡检查可为正常表现,或为非特异的异常如斑块、溃疡、瘘或肿块等。不同病原体引起的食管感染在X线中的表现可相对特异,如黏膜呈长绒毛状提示念珠菌感染;无数小火山形小溃疡可提示HSV感染;线性深溃疡则提示CMV或HIV感染。
CT扫描可以反映食管炎患者的食管壁厚度。放射学检查主要可以作为不适用内镜检查患者的协助诊断。
(二)内镜检查
对于感染性食管炎的诊断非常重要。
1.念珠菌性食管炎
可见充血和散在的黏附紧密的黄白色斑,内含微生物、炎症细胞与黏膜坏死组织,周围可有红斑水肿表现。损伤多位于远端1/3食管,可进展至线性融合、大片融合斑块、溃疡、管腔狭窄和坏死、食管穿孔。确诊依赖内镜下直接刷取和活检。
2.HSV食管炎
起初表现为无数疱疹,以后表现为很多小的火山样浅溃疡(通常<2cm),由疱疹破溃形成。病变主要累及食管下半部分,亦可累及全食管甚至胃。确诊应在内镜检查时做刷拭、活检和病毒培养或PCR技术检测病毒核酸。
3.CMV食管炎
出现大而深的线性溃疡(通常>2cm),单独或多发,位于食管中远端,溃疡边缘清晰,溃疡之间的黏膜相对正常。组织病理学是最可信的诊断方法,从溃疡边缘和基底部取黏膜和黏膜下标本行常规HE染色,可发现肿大内皮细胞和成纤维细胞含有大的、致密的核内包涵体。
4.EB病毒性食管炎
见广泛性溃疡,累及食管上中1/3,在食管组织中行PCR可检出EB病毒DNA。
5.HPV感染
HPV 感染相关病变常位于中下端食管,表现为红色斑点、白色斑点、结节状或分叶状隆起。活检后组织病理学检测及免疫组织化学染色可帮助诊断。
【诊断与鉴别诊断】
详细的病史询问、体格检查及咽拭子检查等可基本诊断疾病。确诊需要内镜检查和相应的刷拭、活检和病原体培养等。
需与以下疾病鉴别:胃食管反流病、贲门失弛缓症、食管白斑、食管癌、裂孔疝、食管良性肿瘤、食管内异物等。
【药物治疗】
(一)针对病原体的特定治疗
1.抗真菌药物
氟康唑是治疗念珠菌属感染的首选药物,但耐药现象普遍,也可选择伊曲康唑、伏立康唑、泊沙康唑、两性霉素B、卡泊芬净、阿尼芬净等。
2.抗病毒药物
可选择阿昔洛韦、更昔洛韦、万乃洛韦和伐昔洛韦等,其中阿昔洛韦和更昔洛韦是具有高度活性的广谱抗病毒药物,对病毒性食管炎尤其CMV食管炎疗效明显。
3.激素和免疫调节剂
泼尼松和沙利度胺对HIV患者的口腔和食管阿弗他溃疡治疗有效。
(二)根据基础疾病及免疫抑制程度给予个体化治疗
1.HSV食管炎
轻型无须抗病毒药物治疗,若症状持久,可试用阿糖腺苷静脉注射,如存在HSV口腔炎或唇炎,或食管症状很严重时,需要静脉使用阿昔洛韦,每8小时1次,每次5mg/kg;或口服阿昔洛韦,每日4次,每次800mg,多在1周内起效,但大的溃疡愈合及被覆上皮修复则需要较长时间,疗程可延长至2~3周或更长时间。
2.伴有免疫缺陷的CMV食管感染
静脉滴注更昔洛韦,每日1次或2次,每次5mg/kg,疗程10~14日;或静脉注射膦甲酸钠,每8或12小时1次,每次90mg/kg,疗程持续至溃疡愈合。
3.非AIDS患者的食管念珠菌病
可口服制霉菌素或克霉唑片剂口内融化,如患者发热且中性粒细胞减少(<1000个/μl),经验性抗真菌药应足量全身用药。
4.同种异体骨髓移植受体
如果移植前存在中性粒细胞减少,需预防性应用抗病毒治疗直到移植物移入。食管感染通常发生于移植完成约6周后,此时如果中性粒细胞计数尚处于正常范围,该类人群中CMV和HSV感染几乎和念珠菌属一样常见,治疗药物依据病原诊断结果选择。
5.实体器管移植受体
食管炎的治疗应取决于内镜下表现和病原。真菌感染比较常见,治疗药物可选唑类、棘白菌素类,或两性霉素B类,必要时可以联合用药。需注意抗真菌药物与免疫抑制剂的药物间相互作用,如氟康唑或伊曲康唑可能导致他克莫司和环孢素血药浓度升高,故需监测后者的血药水平。
6.HPV感染
小病灶无须特殊治疗,较大的病变可行内镜下切除。
【预后】
尽早诊断,积极治疗原发病,及时合理使用抗生素治疗,食管感染一般预后良好。但如果患者得不到及时有效的治疗,可能引发并发症,如食管运动功能障碍、贲门失弛缓症、食管瘢痕形成及狭窄、食管憩室、食管-支气管窦道等。
主要参考文献
1.Pace F,Antinori S,Repici A.What is new in esophageal injury(infection,drug-induced,caustic,stricture,perforation)?Curr Opin Gastroenterol,2009,25(4):372-379.
2.Canalejo CE,Garcia DF,Cabello N,et al.Herpes esophagitis in healthy adults and adolescents-report of 3 cases and review of the literature.Medicine,2010,89(4):204-210.
3.Gary WF,David AK.Chapter 138.Diseases of the esophagus.Goldman's Cecil Medicine,25th ed.Elsevier Saunders,2016:896-908.
第四节
食管肿瘤

刘 懿
一、食管良性肿瘤
食管良性肿瘤在临床上比较少见,占食管肿瘤的10%以下,一般发病年龄较食管癌小,病程进展缓慢。Nemir根据其组织来源分为三类:
(一)上皮性肿瘤
包括:①鳞状上皮:乳头状瘤、囊肿;②腺上皮:腺瘤、息肉。
(二)非上皮性肿瘤
包括:①肌瘤:平滑肌瘤、纤维肌瘤、脂肪肌瘤、纤维瘤;②血管来源:毛细血管瘤、淋巴管瘤;③中胚叶及其他来源:脂肪瘤、黏液纤维瘤、网织内皮瘤、巨细胞瘤、神经纤维瘤、骨软骨瘤。
(三)异位组织
来源于先天性异位组织的肿瘤,如胃黏膜、胰腺、甲状腺结节、皮脂腺、色素母细胞、颗粒母细胞瘤。
既往认为最常见的食管良性肿瘤为平滑肌瘤,但目前多将平滑肌瘤归入胃肠道间质瘤(GIST)范畴(参见本篇第六章第二节“胃肠道间质瘤”)。食管平滑肌瘤直径小于5cm者很少引起症状,临床表现无特异性,诊断主要依靠食管X线钡餐、内镜检查和超声内镜检查。内镜表现主要为凸入食管腔的半圆形、椭圆形、结节状肿物,可随吞咽、呼吸上下移动,肿物表面黏膜光滑完整,皱襞消失,黏膜内血管清晰可见,用镜头触压肿物有滑动感。由于食管平滑肌瘤位于食管肌层,镜下咬取活检位置往往较浅,难以取到肿瘤组织(图15-4-2)。
超声内镜下食管良性肿瘤多表现为境界清晰的弱回声占位病变,位于黏膜下层或固有肌层,但脂肪瘤则表现为黏膜下层境界清晰的强回声肿块。超声内镜还能准确地将食管良性肿瘤与食管外压性疾病相鉴别(图15-4-2)。
食管息肉、腺瘤可通过内镜下摘除,黏膜下隆起怀疑GIST者应手术治疗。
二、食 管 癌
食管癌(carcinoma of esophagus)是主要起源于食管鳞状上皮和柱状上皮的恶性肿瘤,其中,食管鳞癌约占90%,食管腺癌约占10%,罕见有平滑肌肉瘤、黑色素瘤、淋巴瘤、浆细胞瘤及转移癌等。我国是食管癌的高发区,也是食管癌病死率最高的国家之一,19个县市年死亡率超过100/10万人以上,年死亡率最高者达303.37/10万人。食管癌最典型的临床表现为进行性吞咽困难。
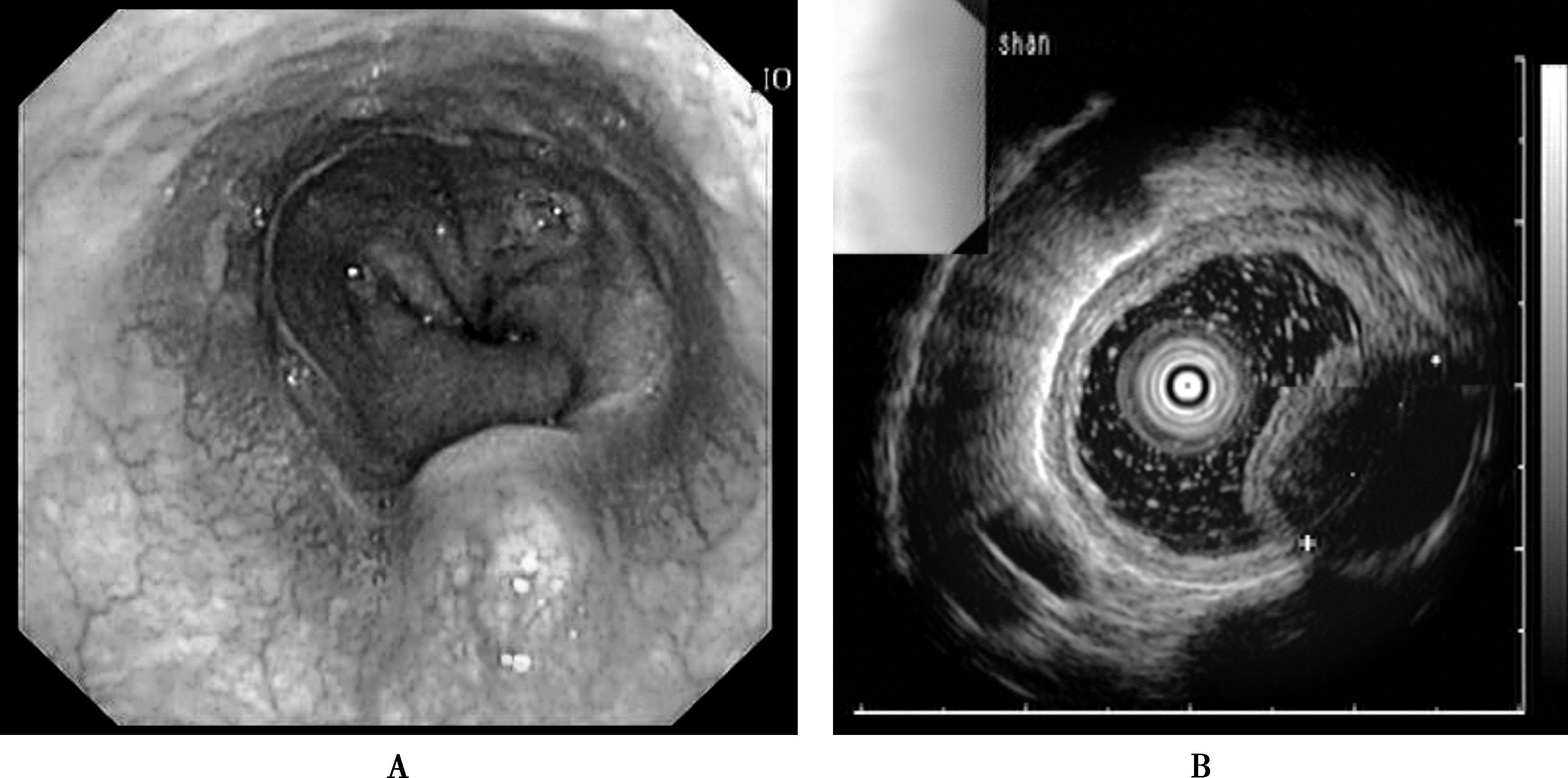
图15-4-2 食管下端黏膜下隆起内镜和超声内镜表现
【流行病学】
本病发病情况在不同国家和地区相差悬殊,同一国家的不同地方或不同民族之间也有明显差异。高发地区和低发地区的发病率可相差60倍,我国食管鳞癌新发病例数约占世界新发鳞癌总数的53%,腺癌则占世界的18%,我国食管癌发病数和死亡数均占世界同期的约49%,农村发病率与死亡率年龄标化后两者差距超过2倍。近年来,城市的食管癌死亡率下降了29.21%,男性食管癌发病率与死亡率仍高于女性,男女比例接近2∶1。
【病因和发病机制】
本病的确切病因尚未完全清楚,但某些理化因素的长期刺激和食物中致癌物质,尤其是硝酸盐类物质过多是食管癌的重要病因,同时食物中微量元素和矿物质的缺乏、酗酒、抽烟、基因突变、遗传因素等也可能参与本病发生。
(一)饮食和生活方式
真菌霉素的致癌作用早为人们所注意。镰刀菌、白地霉菌、黄曲霉菌和黑曲霉菌等真菌不但能将硝酸盐还原成亚硝酸盐,还能增加亚硝胺的合成。维生素A、E、C等缺乏可加强硝酸盐类物质的致癌作用。
吸烟和饮酒因素:吸烟、饮酒是食管鳞癌明确的危险因素。
口腔卫生因素:口腔卫生条件差,增加罹患食管鳞癌的风险。
(二)遗传背景
我国食管癌的发病有明显的家族聚集现象,这与人群的易感性与环境条件有关。已发现,高发区内与家族共同生活20年以上的食管癌患者占1/2。在某些癌症高发家族中,常有抑癌基因,如 p 53基因的点突变或等位基因的杂合性丢失,在这类人群中,如有后天因素引起另一条等位基因的突变,使抑癌基因失活而形成癌肿。
(三)感染因素
人类乳头瘤病毒(human papillomavirus,HPV)感染是一些食管癌高发区的重要致病因素,尤其是HPV-16与食管鳞癌发生呈正相关,HPV感染者罹患食管鳞癌的风险比常人升高近3倍。
(四)其他因素
Barrett食管指食管下段的复层鳞状上皮被化生的单层柱状上皮所替代的一种病理现象,可伴有肠上皮化生,Barrett食管相关异型增生则是腺癌的癌前病变。贲门失弛缓症患者进展为食管鳞癌的风险是正常人的16~33倍。
【病理】
食管癌可发生在下咽部到食管-胃接合部之间的食管任何部位。我国统计资料显示,食管中段最多,约52.69%~63.33%,下段次之,约24.95%~38.92%,上段最少。
(一)临床病理分期
食管癌的临床病理分期对治疗方案的选择及疗效评定有重要意义。
1.早期食管癌及癌前病变的内镜下分型及病变层次
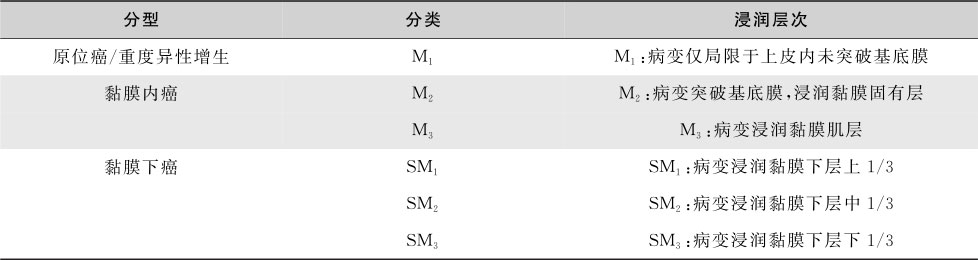
(1)早期食管癌及癌前病变的内镜下分型(表15-4-3):依照2002年巴黎分型标准和2005年巴黎分型标准更新版:
(2)病变层次分类:见表15-4-4。
表15-4-3 早期食管癌及癌前病变的内镜下分型

表15-4-4 早期食管癌病变层次分类
(3)病变内镜下形态与病变层次的关系:黏膜内癌通常表现为0~Ⅱb型、0~Ⅱa型及0~Ⅱc型,病灶表面光滑或呈规则的小颗粒状;而黏膜下癌通常为0~Ⅰ型及0~Ⅲ型,病灶表面呈不规则粗颗粒状或凹凸不平小结节状。应用上述标准,可初步预测病变所达层次。我国学者将早期食管癌病理形态分为隐伏型(充血型)、糜烂型、斑块型和乳头型,隐伏型多为原位癌;糜烂型大部分为原位癌,部分为早期浸润癌,癌细胞分化较差;斑块型最多见,大部分为早期浸润癌,癌细胞分化较好;乳头型主要为早期浸润癌,癌细胞分化一般较好。
2.食管癌TNM标准
参考2010年AJCC组织修订的《癌症分期手册》食管癌TNM分期标准第7版。
(二)病理形态分型
1.早期食管癌(early esophageal cancer)
按其形态可分为隐伏型、糜烂型、斑块型和乳头型。国内有人对100例早期食管癌大体形态作研究后建议,除上述4型外,增加表浅糜烂型和表浅隆起型。
显微镜下可见肿瘤侵及黏膜下层或黏膜肌层,包括:斑块型、乳头型、表浅糜烂型、表浅隆起型等,其中斑块型是最常见的早期食管癌,约占总数的1/2左右。
2.进展期食管癌(advanced esophageal cancer)
可分为髓质型、蕈伞型、溃疡型、缩窄型、腔内型。除上述分型外,临床还常见两型同时存在的混合型,此外,尚有5%无法确定其类型。
(三)组织学分型
鳞状细胞癌:最多,约占90%;腺癌:较少见,又可分为单纯腺癌、腺鳞癌、黏液表皮样癌和腺样囊性癌等4个亚型;食管上、中段绝大多数为鳞癌,而下段则多为腺癌。
【食管癌的扩散和转移方式】
(一)食管壁内扩散
食管癌旁上皮的底层细胞癌变是肿瘤的表面扩散方式之一。癌细胞还常沿食管固有膜或黏膜下层的淋巴管浸润。
(二)直接浸润邻近器官
食管上段癌可侵入喉部/气管及颈部软组织,甚至侵入甲状腺;中段癌可侵入支气管,形成支气管-食管瘘,也可侵入胸导管、奇静脉、肺门及肺组织,部分可侵入肺动脉,形成食管-主动脉瘘,引起大出血致死;下段癌可累及心包。受累脏器的频度依次为肺和胸膜、气管和支气管、脊柱、心及心包、主动脉、甲状腺及喉等。
(三)淋巴转移
中段癌常转移至食管旁或肺门淋巴结;下段癌常转移至食管旁、贲门旁、胃左动脉及腹腔等淋巴结,偶可至上纵隔及颈部淋巴结。淋巴转移的频度依次为纵隔、腹部、气管及气管旁、肺门及支气管旁。
(四)血行转移
多见于晚期患者。常见的转移部位依次为肝、肺、骨、肾、肾上腺、胸膜、网膜、胰腺、心、甲状腺和脑等。
【临床表现】
(一)早期症状
在食管癌的早期,局部病灶刺激食管,如炎症、肿瘤浸润、食管黏膜糜烂、表浅溃疡引起食管蠕动异常或痉挛。症状一般较轻,持续时间较短,常反复出现,持续时间可达1~2年。临床表现为胸骨后不适、烧灼感或疼痛,食物通过时局部有异物感或摩擦感,吞咽食物有停滞感或轻度梗阻感。下段癌还可引起剑突下或上腹部不适、呃逆、嗳气。
(二)后期症状
1.吞咽困难
是食管癌的典型症状。吞咽困难在开始时常为间歇性,可以因食物堵塞或局部炎症水肿而加重,也可因肿瘤坏死脱落或炎症消退而减轻。但总趋势呈持续性存在,进行性加重,如出现明显吞咽障碍时,肿瘤常已累及食管周径的2/3以上。吞咽困难的程度与食管癌的病理类型有关,缩窄型和髓质型癌较为严重。有约10%患者就诊时可无明显吞咽困难。
2.反流
食管癌的浸润和炎症反射性地引起食管腺和唾液腺黏液分泌增加。当肿瘤增生造成食管梗阻时,黏液积存于食管内引起反流,患者可以表现为频繁吐黏液,所吐黏液中可混有食物、血液等,反流还可引起呛咳,甚至吸入性肺炎。
3.疼痛
胸骨后或背部肩胛间区持续性疼痛常提示食管癌已向外浸润,引起食管周围炎、纵隔炎,疼痛也可由肿瘤导致的食管深层溃疡引起;下胸段或贲门部肿瘤引起的疼痛可位于上腹部。
4.其他
肿瘤侵犯大血管,特别是胸主动脉而造成致死性大出血;肿瘤压迫喉返神经可致声音嘶哑,侵犯膈神经可致呃逆;压迫气管或支气管可致气急或干咳等。
(三)体征
早期体征不明显。晚期因患者进食困难,营养状况日趋恶化,患者可出现消瘦、贫血、营养不良、失水和恶病质。当肿瘤有转移时,可有大量腹水形成。
【辅助检查】
(一)影像学检查
1.食管钡餐检查
目前较多指南不推荐使用上消化道钡餐检查进行早期食管鳞癌及癌前病变的诊断。
2.食管CT检查
CT是目前国内在进行食管癌临床分期时应用最为普遍的影像学手段。CT扫描对食管癌术前T分期和N分期诊断的准确率超过70%。对局部淋巴结及腹腔淋巴结转移诊断的敏感性均不如EUS。CT诊断远处转移的敏感性和特异性分别为52%和91%。
3.正电子发射成像(PET)
PET-CT敏感性及特异性较低,分别为57%和85%。
(二)内镜检查
1.普通白光内镜
食管黏膜病灶有以下几种状态:①红区;②糜烂灶;③斑块;④结节;⑤黏膜粗糙;⑥局部黏膜上皮增厚的病灶。内镜医师应提高对上述特征的认识,在检查时注意观察黏膜的细微变化,锁定可疑区域是开展后续精查的基础。(图15-4-3)。
2.色素内镜
将各种染料散布或喷洒在食管黏膜表面后,使病灶与正常黏膜在颜色上形成鲜明对比,更清晰的显示病灶范围,并指导指示性活检。色素内镜包括:①碘染色;②甲苯胺蓝染色;③联合染色:如碘液-甲苯胺蓝染色法和碘液-亚甲蓝染色法对早期食管麟癌及癌前病变检出的准确率高于单一碘染色,且对病变浸润程度评估也有一定价值。
3.电子染色内镜
通过特殊的光学处理实现对食管黏膜的电子染色,比白光内镜能更清楚显示黏膜表面结构、微血管形态及病变范围,又可弥补色素内镜的染色剂不良反应及染色耗时长等不足。
窄带成像技术(narrow band imaging,NBI)已广泛应用于临床,其对早期食管癌的诊断价值已得到公认。NBI在食管鳞癌筛查方面较普通白光内镜有明显优势。利用NBI结合放大内镜观察食管上皮乳头内毛细血管袢(intrapapillary capillary loops,IPCL)和黏膜微细结构有助于更好地区分病变与正常黏膜及评估病变浸润深度,已成为早期食管癌内镜精查的重要手段。智能电子分光技术(flexible spectral imaging color enhancement,FICE)将白光分解成不同波段,可进行多达50种光谱组合,从而获得不同黏膜病变的最佳图像,能较清晰显示IPCL,可作为碘染色的重要补充。
4.放大内镜(magnifying endoscopy)
有利于观察组织表面显微结构和黏膜微血管网形态特征的细微变化,尤其在与电子染色内镜相结合时,其对黏膜特征显示更为清楚,可提高早期食管癌诊断的准确性,指导治疗方式的选择。
5.共聚焦激光显微内镜(confocallaser endomicroscopy,CLE)
CLE可将组织放大至1000倍,从微观角度显示细胞及亚细胞结构,在无须活检的情况下即可从组织学层面区分病变与非病变区域,实现“光学活检”的效果。
6.蓝激光内窥系统(LASEREO)
蓝激光内窥系统可提供四种观察模式(白光、BLI、BLI-bright、FICE),为消化道疾病的诊疗提供全面的观察方法。
7.超声内镜(endoscopic ultrasound,EUS)
EUS下早期食管癌的典型表现为局限于黏膜层且不超过黏膜下层的低回声病灶。可清楚显示食管壁层次结构的改变、食管癌浸润深度及病变与邻近器官的关系,分期准确性可达74%~86%,但对浸润深度诊断的准确性易受病变大小及部位影响(图15-4-3)。
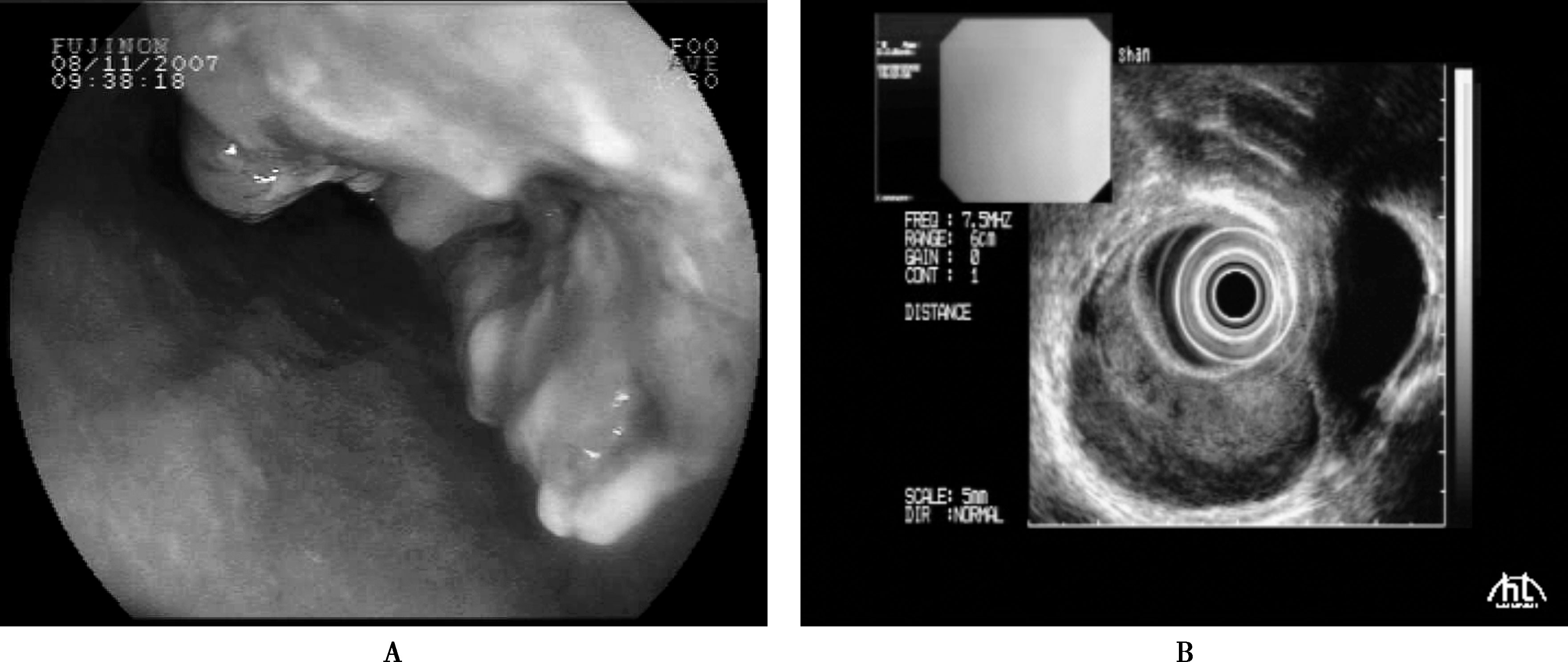
图15-4-3 食管癌内镜和超声内镜表现
【诊断与鉴别诊断】
(一)诊断
依据临床表现和辅助检查,典型的食管癌诊断并无很大困难,但早期食管癌的诊断常因患者缺乏明显症状而延误。对食管癌高发区的高危人群作普查是一项发现早期食管癌、降低食管癌相关死亡率的重要工作。各种内镜特别是超声内镜结合病理检查对早期食管癌的诊断价值最大。
(二)鉴别诊断
本病应与下列疾病鉴别:
1.贲门失弛缓症
吞咽困难也是本病的明显症状之一,但其达到一定程度后即不再加重,情绪波动可诱发症状的发作。食管钡餐检查时,可见食管下端呈光滑的漏斗状或鸟嘴状狭窄;食管测压对本病的诊断有重要价值。
2.食管良性狭窄
可由误吞腐蚀剂、食管灼伤、异物损伤、慢性溃疡引起的瘢痕所致,食管钡餐检查可见食管狭窄、黏膜消失、管壁僵硬,狭窄与正常食管段逐渐过渡。内镜加直视下活检可明确诊断。
3.食管良性肿瘤
主要为少见的平滑肌瘤。吞咽困难较轻,进展慢,病程长。食管钡餐、内镜及EUS检查有助于诊断。
4.食管周围器官病变
如纵隔肿瘤、主动脉瘤、甲状腺肿大、心脏增大等均可造成食管不同程度的狭窄,食管钡餐等检查有助于鉴别。
5.癔症球
又称梅核气。多见于青年女性,时有咽部异物感,但对进食无妨碍,其发病常与精神因素有关。
【治疗】
食管癌的治疗方法主要为外科手术及包括放疗、化疗、经内镜治疗等在内的非手术治疗,目前,还推崇手术与放疗、化疗相结合的综合治疗方法。
(一)内镜下切除治疗
与传统外科手术相比,早期食管癌及癌前病变的内镜下切除具有创伤小、并发症少、恢复快、费用低等优点,且二者疗效相当,5年生存率可达95%以上。原则上,无淋巴结转移或淋巴结转移风险极低、残留和复发风险低的病变均适合进行内镜下切除。早期食管癌常用的内镜切除技术主要包括内镜下黏膜切除术、内镜下黏膜剥离术等。
早期食管癌和癌前病变内镜下切除的绝对适应证:①病变局限在上皮层或黏膜固有层(M 1 、M 2 );②食管黏膜重度异型增生。
早期食管癌和癌前病变内镜下切除的相对适应证:①病变浸润黏膜肌层或黏膜下浅层(M 3 、SM 1 ),未发现淋巴结转移证据;②范围大于3/4环周、切除后狭窄风险大的病变可视为内镜下切除的相对适应证,但应向患者充分告知术后狭窄等风险。
早期食管癌和癌前病变内镜下切除的绝对禁忌证:①明确发生淋巴结转移的病变;②若术前判断病变浸润至黏膜下深层,有相当比例患者内镜下切除无法根治,原则上应行外科手术治疗;③一般情况差、无法耐受内镜手术者。
早期食管癌和癌前病变内镜下切除的相对禁忌证:①非抬举征阳性;②伴发凝血功能障碍及服用抗凝剂者,在凝血功能纠正前不宜手术;③术前判断病变浸润至黏膜下深层,患者拒绝或不适合外科手术者。
(二)手术
手术切除是食管癌治疗的首选方法。手术适应证:①UICC分期中的0、Ⅰ、Ⅱa、Ⅱb及Ⅲ期中的T 3 N 1 M 0 ;②非手术治疗无效或复发病例,尚无局部明显外侵或远隔转移征象。禁忌证:①Ⅲ期中T 4 任何NM 0 及Ⅳ期;②恶病质;③有心脏、肺等脏器功能不全者。影响手术治疗预后的因素有切除是否彻底、癌的分期、有无淋巴结转移及肿瘤外侵程度等。早期食管癌的手术切除率为100%,手术死亡率为0~2.9%,5年和10年生存率分别可达90%和60%。
(三)放疗
由于食管癌主要是鳞癌,对放疗较敏感。放疗的适应证较外科手术为宽,早、中期患者如因病变部位高而不愿手术,或因有手术禁忌证而不能手术者均可作放疗。对晚期患者,即使已有左锁骨上淋巴结转移者也应尽量作姑息治疗,但已穿孔或有腹腔淋巴结、肝、肺或骨的广泛转移时,则不宜再作放疗。放疗最常见的反应和并发症为放射性食管炎、气管炎、食管穿孔、食管-气管瘘和出血。放疗中食管穿孔、食管-气管瘘和出血大多为肿瘤外侵、放疗后退缩所致,并非超量放射损伤。
(四)化疗
化疗通常用于不能手术或放疗的晚期病例,其疗效虽仍不满意,但对于预防和治疗食管癌的全身转移,化疗是目前唯一确切有效的方法,因此化疗在食管癌的治疗中占有重要位置。单药化疗有效率在6%~37%,联合化疗的有效率在10%~86%。NCCN推荐术前化疗采用5-FU/DDP(顺铂)或紫杉醇为主的方案,术后化疗采用紫杉醇为主的方案。联合5-FU+DDP或5-FU+NDP(奈达铂)方案是研究最多和使用最多的方案,报道的有效率在 20%~50%之间;如:DDP 80~100mg/m 2 ,静脉滴注,d1~d3;5-FU 500~750mg/m 2 ,d1~d5;每一个疗程为3个周期;或NDP 80~100mg/m 2 ,脉滴注2小时d1;5-FU 500~750mg/m 2 ,d1~d5;每4周为1个周期,一个疗程为3个周期。
(五)综合治疗
食管癌的综合治疗主要有4种形式:术前或术后放疗,化疗后手术,化疗加放疗后再手术,放疗加化疗。资料表明,到目前为止,术前加化放疗的疗效最显著,其手术切除率达49%~91%,5年生存率达34%。有关研究的病例数均较少,随访时间也较短,其疗效有待进一步的研究。
【预防】
1.改变不良饮食习惯,不吃霉变食物,少吃或不吃酸菜。
2.改良水质,减少饮水中亚硝酸盐含量。
3.推广微量元素肥料,纠正土壤缺乏硒、钼等元素的状况。
4.积极治疗反流性食管炎、食管-贲门失弛缓症、Barrett食管等与食管癌相关的疾病,同时积极应用维生素E、维生素C、维生素B 2 、叶酸等治疗食管上皮增生以阻断癌变过程。
5.易感人群监测,普及防癌知识,提高防癌意识。
主要参考文献
1.中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜专业委员会:中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京).中国实用内科学杂志,2015,35(4):320-337.
2.中华医学会消化内镜学分会病理学协作组.中国消化内镜活检与病理学检查规范专家共识(草案).胃肠病学,2014,19(9):549-553.
3.Ajani JA,D'Amico TA,Almhanna K,et al.Esophageal and Esophagogastric Junction Cancers,Version 1.2015.Journal of the National Comprehensive Cancer Network,2015,13(2):194-227.


